1、选择题 根据下列实验内容得出的结论正确的是
?
| 实验操作
| 解释或结论
|
A
| 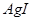 沉淀中滴入浓KCI溶液有白色沉淀出现 沉淀中滴入浓KCI溶液有白色沉淀出现
| 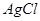 比 比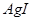 更难溶 更难溶
|
B
| 某物质的水溶液能使红色石蕊试纸变蓝
| 该物质一定是氨气
|
C
| 滴加氯水和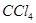 振荡,静置,下层溶液为紫色 振荡,静置,下层溶液为紫色
| 原溶液中有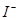
|
D
| 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色
| 含有Na单质
|
?
参考答案:C
本题解析:A、在相同条件下,AgI比AgCl更难溶,、错误;B、某物质的水溶液能使红色石蕊试纸变蓝,溶液呈碱性,不一定为碱溶液,可能为水解呈碱性的盐,错误;C、滴加氯水和CCl4振荡,静置,下层溶液为紫色,原溶液中有I—,正确;D、用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色,该物质中含有钠元素,不一定为钠单质,错误。
本题难度:一般
2、选择题 已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
[? ]
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于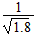 ×10-11mol·L-1?
×10-11mol·L-1?
参考答案:A
本题解析:
本题难度:一般
3、简答题 硫酸钙是一种用途非常广泛的产品.
(1)25℃时,Ksp(CaSO4)=7.10×10-5.在1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为______mol?L-1.
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4?yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示.

①x:y=______.
②t2~t3时间段固体的化学式为______.
③t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为______.
参考答案:(1)1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后,Na2SO4过量,
反应后溶液中c(SO42-)=1L×0.2mol/L-1L×0.1mol/L2L=0.05mol/L,
又:Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,
c(Ca2+)=7.10×10-50.05mol/L=1.42×10-3mol/L,
故答案为:1.42×10-3;
(2)①在加热到t1时xCaSO4?yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原 因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,
则m(H2O)=3.26g-2.72g=5.4g,m(CaSO4)=2.72g,
n(H2O)=5.4g18g/mol=0.3mol,n(CaSO4)=2.72g136g=0.2mol,
所以n(CaSO4):n(H2O)=x:y=0.2:0.3=2:3,
故答案为:2:3;
②生石膏在加热条件下失去部分水生成熟石膏,熟石膏的主要成分为2CaSO4?H2O 或CaSO4?12H2O,
故答案为:2CaSO4?H2O 或CaSO4?12H2O;?
③在t4时完全生成CaSO4,在t5~t6时间段温度较高,CaSO4开始分解,产生了两种气体,其中一种能使品红溶液褪色,则该气体为二氧化硫,反应的方程式为2CaSO4?高温?.?2CaO+2SO2↑+O2↑,
故答案为:2CaSO4?高温?.?2CaO+2SO2↑+O2↑.
本题解析:
本题难度:一般
4、填空题 (14分)钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
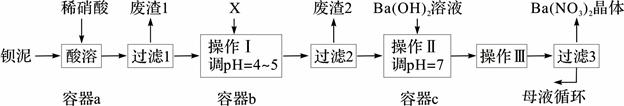
已知:i Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
参考答案:(1)BaSO4(s)+CO32-(aq) 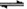 BaCO3(s)+SO42-(aq)(不写(s)、(aq)不扣分)增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质(3分);
BaCO3(s)+SO42-(aq)(不写(s)、(aq)不扣分)增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质(3分);
(2)Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O (2分);
(3)③(2分);Fe(OH)3(2分);(4)c(2分);(5) ×100%(3分)
×100%(3分)
本题解析:(1)在溶液中存在平衡:BaSO4(s)+CO32-(aq) 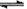 BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3(2分);(4)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(5)mg沉淀应该是硫酸钡,则碳酸钡的质量是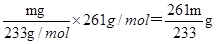 ,所以其纯度为
,所以其纯度为 ×100%。
×100%。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
5、选择题 用0.1mol·L-1 AgNO3溶液分别滴定20.00mL浓度均为 0.1mol·L-1 Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标, pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得下图滴定曲线。已知25℃时:
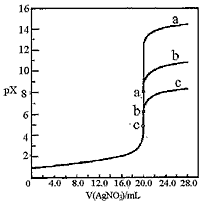

有关说法不正确的是
[? ]
A.用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol·L-1 K2CrO4 溶液1~2滴作指示剂
B.a、b、c依次分别表示Cl-、Br-及I-
C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液, 当两种沉淀共存时,c (Br-)/c(Cl-) =2.7×10-3
D.若用硝酸银溶液滴定NaI溶液,当pX=13时, 溶液中c (Ag+)≈0.64×10-17
参考答案:BD
本题解析:
本题难度:一般