1、简答题 难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp).例如:Cu(OH)2
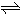
Cu2++2OH-,Ksp=c(Cu2+)?[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______.
(2)要使0.2mol?L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
2、选择题 下列表述中,不正确的是
[? ]
A.用稀盐酸洗涤AgCl沉淀比用水洗涤,损耗AgCl少
B.等体积的pH均等于3的盐酸和AlCl3溶液中,已电离的水分子数前者一定小于后者
C.高效催化剂可使水分解,同时释放能量
D.明矾用于净水和氯气用于自来水的杀菌消毒,两个反应遵循的化学原理不同
3、选择题 下列有关叙述正确的是
A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)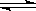 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl)
4、填空题 (12分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: 。
5、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4?mol/L.溶度积常数Ksp(CaF2)=1.46×10-10.现向1?L?0.2?mol/L?HF溶液中加入1?L?0.2?mol/L?CaCl2溶液.则下列说法不正确的是
[? ]
A.25℃时,0.1?mol/L?HF溶液中pH>1
B.Ksp(CaF2)随温度的变化而变化
C.氟化钙和氟化氢都是弱电解质
D.该体系中有CaF2沉淀产生