1、选择题 39号元素钇的电子排布式应是下列排布中的哪一种
A.1s22s22p63s23p63d104s24p64d15s2
B.1s22s22p63s23p63d104s24p65s25p1
C.1s22s22p63s23p63d104s24p64f15s2
D.1s22s22p63s23p63d104s24p65s25d1
参考答案:A
本题解析:根据构造原理可知,选项A正确;
本题难度:一般
2 、填空题 现有X、Y、Z、W四种短周期元素原子序数依次增大,其原子半径及主要化合价如下表所示。又知X与Y、Z与W分别位于同一周期,Y、W处于同一主族。
元素
| X
| Y
| Z
| W
|
原子半径/nm
| 0.077
| 0.074
| 0.186
| 0.102
|
主要化合价
| -4,+4
| -2
| +1
| -2,+6
|
请回答:
小题1:X位于元素周期表的? ?,画出Z原子结构示意图? ?,
Z2W是离子晶体,写出其电子式? ?。
小题2:X单质能与某酸(H2WY4)的浓溶液发生反应,产物有XY2、WY2和水,
其反应的化学方程式为?;
小题3:Z2Y2可与XY2发生反应可给潜水艇供氧,其反应的化学方程式为?;
若反应中转移电子数为3.01×1023,则所得气体产物的体积是?(标准状况)。
小题4:Y、Z、W三种元素可组成质量比为5.75 : 8 : 4的某种化合物。实验室检验该化合物中所含阴离子的操作方法及有关实验现象是:取少量含该阴离子的溶液,?,则证明原溶液中含有该阴离子。
参考答案:
小题1:二周期ⅣA族?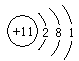 、
、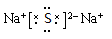
小题2:C + 2H2SO4(浓)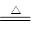 CO2 ↑+ 2SO2 ↑+ 2H2O
CO2 ↑+ 2SO2 ↑+ 2H2O
小题3:2Na2O2 + 2CO2 = 2Na2CO3 + O2↑? 5.60L
小题4:滴加少量的硝酸钡溶液(盐酸和氯化钡溶液),如产生白色沉淀
本题解析:考查元素周期表的结构和元素周期律的应用。根据化合价可知判断X、Y、Z、W
四种短周期元素分别属于第ⅣA、ⅥA、IA、ⅥA。因为同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以X、Y、Z、W四种短周期元素分别为C、O、Na、S。过氧化钠和CO2的反应中,过氧化钠既作氧化剂,还是还原剂。根据方程式可判断每生成1mol氧气,反应中就转移2mol电子。所以当反应中转移电子数为3.01×1023,所得氧气是0.25mol,其体积是22.4L/mol×0.25mol=5.6L。O、Na、S三种元素的质量比为8 :5.75 : 4,则其原子个数之比是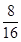 ︰
︰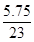 ︰
︰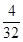 =4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。
=4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。
本题难度:一般
3、填空题 (14分)X、Y、Z、W、R是五种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y?元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请填写下列空白:
(1)画出W的原子结构示意图;?。
(2)Z和W最高价氧化物的水化物的碱性较强的是:?(写化学式),它们之间在溶液中反应的离子方程式是;?;
(3)Z2Y2 中阴离子的化学式是?。
(4)在同周期元素中,R 元素及与其相邻元素的原子半径从大到小的顺序是:?。与R元素同周期且非金属性最强的元素是:?。
(5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:?。
参考答案:(每空2分,共14分)(1)略。
(2)NaOH;?Al(OH)3 +OH-=AlO2-+2H2O。
(3)O22-。?(4) P﹥S﹥Cl;?氯或Cl。
(5)4Al+3C+3TiO2 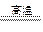 ?2Al2O3 +3TiC
?2Al2O3 +3TiC
本题解析:略
本题难度:简单
4、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个。
(1)写出下列元素的符号:A?, E?。
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是?。
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是?。
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为?。
(5)用电子式表示B和F形成化合物的过程________________
参考答案:(1)Na? P?(2)Al(OH)3+OH-=AlO2-+2H2O(3)Al2O3+2NaOH= 2NaAlO2+2H2O
(4) [Ar]3d104s24p5?
(5)2Mg2++
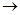 Mg2+
Mg2+ Mg2+
Mg2+
本题解析:A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则是酸碱的中和反应,那么C只能是具备两性的Al(OH)3,A为Na;D元素原子的最外层电子数比次外层少4个,所以D为Si;E元素原子次外层电子数比最外层多3个,则E为P,故F只能为Cl。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。
本题难度:一般
5、选择题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
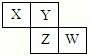
A.原子半径:W>Z>Y>X
B.相等物质的量浓度的气态氢化物溶液的pH: X>Z>W
C.最高价氧化物对应水化物的酸性:Z>W>X
D.四种元素的单质中,Z单质的熔沸点最低
参考答案:B
本题解析:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素。A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;B、四种元素对应的氢化物分别为NH3、H2O、H2S、HCl,其中NH3的水溶液呈碱性,H2O呈中性,H2S为弱酸,HCl的水溶液为强酸,所以相等物质的量浓度的气态氢化物溶液的pH:X>Y>Z>W,故B正确;C、同周期元素从左到右元素的非金属性逐渐增强,根据元素的非金属性越强,对应最高价氧化物的水化物的酸性越强可知最高价氧化物对应水化物的酸性:W>Z,故D错误;D、四种元素对应的单质中,S在常温下为固体,熔沸点最高,其它元素对应的单质在常温下为气体,故D错误。
本题难度:一般