1、实验题 图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
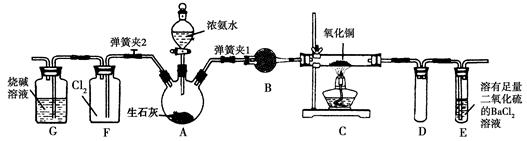
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是_________
__________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
参考答案:(1)关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水
(2)碱石灰(或生石灰)
(3)白色沉淀 2NH3+3CuO 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
(4)Cu2O、Cu
(5)3Cl2+8NH3=N2+6NH4Cl
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸
本题解析:A是制备NH3的装置,B是干燥NH3的装置,C是NH3与CuO的反应装置,E是处理NH3的尾气装置,F是NH3与Cl2的反应装置,G是处理尾气Cl2的装置。
(2)干燥NH3需使用碱性干燥剂。(3)C中CuO与NH3发生氧化还原反应生成红色的Cu、N2和H2O;E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl。(4)若产物全部是Cu,则由差量法知减小的部分全部是O元素的质量,即n(CuO)=n(O)=2.4 g÷16 g·mol-1=0.15 mol,所以反应的CuO的质量为0.15 mol×80 g/mol=12 g<16 g,所以CuO未完全转化成Cu,剩余固体中可能含有Cu2O。(5)Cl2可将NH3氧化为N2,同时生成的HCl会和NH3反应生成NH4Cl,产生白烟现象,F瓶内压强变小从而出现倒吸现象。
点拨:本题考查NH3的制备及性质、化学实验基本操作,考查考生记忆和知识的应用能力。难度中等。
本题难度:困难
2、计算题 3.2 g Cu与过量硝酸(a mol·L-1,30 mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1 mol。
(1)此时溶液中所含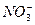 为_______________mol。
为_______________mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH====NaNO3+NaNO2+H2O,NO2+NO+2NaOH====2NaNO2+H2O。
若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
参考答案:(1)0.2
(2)(0.045a-0.35) mol,(0.15-0.015a)mol
(3)8.3≤a<10
本题解析:(1)利用溶液中电荷守恒:n(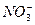 )×1=n(Cu2+)×2+n(H+)×1,所以,n(
)×1=n(Cu2+)×2+n(H+)×1,所以,n(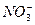 )="0.2" mol
)="0.2" mol
(2)设生成气体中NO2、NO的物质的量分别为X、Y。
由得失电子守恒:X+3Y="0.1" mol
由“N”元素守恒:X+Y="(0.03a-0.2)" mol
解得:X="(0.045a-0.35)" mol;Y="(0.15-0.015a)" mol 。
(3)根据题给信息,完全吸收的条件是n(NO2)≥n(NO)时,才可能被完全吸收。
所以,首先是要保证产生NO、NO2,则列式为①②式:
X>0得:a>7.8①
Y>0得:a<10②
再由必须完全吸收的条件列③式:
X≥Y得:a≥8.3③
所以,三式联立解不等式组,得到a的取值范围:8.3≤a<10。
本题难度:简单
3、实验题 某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。

(1)A中的化学反应方程式:?。
(2)A装置还可用于制取气体?(只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是?L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是?
(5)C、D装置中颜色会发生变化的是?(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是?
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是?(填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列?物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物)? B.NaOH 固体?
C.硫酸溶液?D.石灰石(含CaCO3))
参考答案:(共11分)(1)2NH4Cl?+?Ca(OH)2?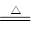 ?CaCl2?+?2NH3↑+?2H2O?(2分)
?CaCl2?+?2NH3↑+?2H2O?(2分)
(2)O2(或氧气,其他合理答案也给分(1分)
(3)8.96 (2分)? (4)向下排空气法(1分)
(5)D(1分)?(6)有白烟生成(1分)?
(7)F(1分)? (8)A B(2分)
本题解析:(1)A装置是实验室制取氨气的,所以A中的化学反应方程式2NH4Cl?+?Ca(OH)2?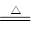 ?CaCl2?+?2NH3↑+?2H2O。
?CaCl2?+?2NH3↑+?2H2O。
(2)A装置的特点是固体和固体加热制备气体的,所以还可以制备氧气。
(3)21.4gNH4Cl固体的物质的量是21.4g÷53.5g/mol=0.4mol,则根据反应的化学方程式可知,生成氨气的体积是0.4mol×22.4L/mol=8.96L。
(4)氨气极易溶于水,且氨气的密度小于空气的,所以实验室收集氨气的方法是向下排空气法。
(5)氨气不能使干燥的红色石蕊试纸变蓝,所以C、D装置中颜色会发生变化的是D。
(6)浓盐酸和氨气反应生成氯化铵固体小颗粒,所以可观察到的现象是有白烟生成。
(7)氨气极易溶于水,进行尾气处理时,要防止倒吸,所以正确的答案选F。
(8)碱石灰或氢氧化钠固体,均易吸水,且增大溶液中OH-离子的浓度,可用于代替生石灰,答案选AB。
点评:该题是基础性试题的考查,试题难易适中,注重基础,兼顾能力的训练和培养,难度不大,学生不难得分。有利于培养学生分析问题、解决问题的能力,也有利于提高学生的规范答题能力和应试能力。
本题难度:一般
4、计算题 (8分)Cu与一定浓度的硝酸反应时,其方程式可表示为:
Cu+HNO3 ——Cu(NO3)2+NO↑+NO2↑+H2O
(1)硝酸在反应中的性质是?。
(2) 0.3molCu被完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是?mol,若用排水法收集这些气体,可得到标准状况下的体积??L。
(3)如果参加反应的Cu和HNO3的物质的量之比为3:10,写出并配平该反应的离子方程式?
参考答案:(1)氧化性、酸性?(2)0.9?; 4.48
(3)3Cu +10H+ +4NO3-==3Cu2+ +NO↑+3NO2↑+5H2O
本题解析:(1)在生成物中有硝酸铜产生,所以体现出硝酸的酸性。又因为硝酸中氮元素的化合价降低,所以还体现了硝酸的氧化性。
(2)根据得失电子守恒可知0.3mol×2=n(NO)×3+n(NO2)×1。因为NO和NO2的体积相等,所以它们的物质的量都是0.15mol,则被还原的硝酸是0.3mol。硝酸铜是0.3mol,所以没有被还原的硝酸是0.6mol,则参加反应的硝酸就是0.3mol+0.6mol0.9mol。NO2溶于水的方程式为3NO2+H2O=2HNO3+NO,所以最后收集到到NO是0.15mol+0.15mol/3=0.2mol,在标准状况下到体积是0.2mol×22.4L/mol=4.48L。
本题难度:一般
5、实验题 (2014届陕西省延安市秋高考模拟理综化学试卷)
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示(5分)

(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______?
II.实验装置如图所示:(5分)
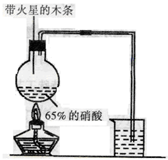
(1)写出浓硝酸受热分解的化学方程式:__________________________________。(2分)
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持?木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是?。(3分)
III.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。(2分)_________________________________________________。
参考答案:I.(1)2Cu(NO3)2?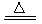 2CuO+4NO2↑+O2↑ (2)正确,2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。?Ⅱ.(1)4HNO3(浓)
2CuO+4NO2↑+O2↑ (2)正确,2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。?Ⅱ.(1)4HNO3(浓) 4NO2↑+O2+2H2O(2)不正确。带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。Ⅲ.用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。
4NO2↑+O2+2H2O(2)不正确。带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。Ⅲ.用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。
本题解析:I.(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气的化学方程式是:2Cu(NO3)2? ?2CuO+4NO2↑+O2↑(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧” 这一结论正确。原因是2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。II.(1)浓硝酸受热分解的化学方程式4HNO3(浓)
?2CuO+4NO2↑+O2↑(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧” 这一结论正确。原因是2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。II.(1)浓硝酸受热分解的化学方程式4HNO3(浓) 4NO2↑+O2+2H2O。(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你这一结论不正确。因为带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。Ⅲ.从新设计的方案是:用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。
4NO2↑+O2+2H2O。(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你这一结论不正确。因为带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。Ⅲ.从新设计的方案是:用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。
本题难度:一般