1、选择题 下列变化中,不属于化学变化的是
[? ]
A.SO2使品红溶液褪色
B.氯水使有色布条褪色
C.活性炭使红墨水褪色
D.过氧化钠使某些染料褪色
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
[? ]
A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
B.利用化学方法,我们可以制造出新的分子,也能制造出新的原子
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.不能用瓷坩埚加热熔融氢氧化钠固体
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列实验过程中产生的现象与对应图形相符合的是( )
A.

盐酸中加入NaAlO2溶液
B.

?SO2气体通入溴水中
C.
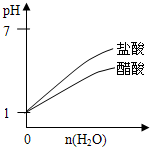
?pH═1的醋酸和盐酸分别加水稀释
D.

氨气通入醋酸溶液中
参考答案:解;A、在盐酸溶液中加入NaAlO2,发生反应分别为AlO2-+4H+═Al3++2H2O,Al3++3AlO2-+6H2O═4Al(OH)3↓,反应开始时没有沉淀生成,故A错误;
B、溴水中存在Br2+H20=HBr+HBrO,溶液呈酸性,则pH<7,SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,故B错误;
C、醋酸为弱酸,加水稀释时进一步电离,pH变化较盐酸小,故C正确;
D、氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故D错误.
故选:C.
本题解析:
本题难度:简单
4、简答题 某化学兴趣小组为探究SO2的性质,按图所示装置进行实验.
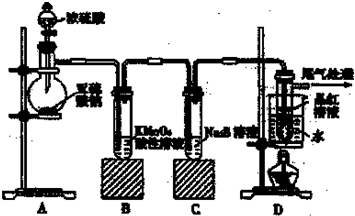
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______.
(2)实验过程中,装置B中产生的现象是______,这个现象说明SO2具有的性质是______.
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是:(用离子方程式)______.
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象______.
(5)如果把分液漏斗中的中的浓H2SO4换作浓HNO3,对此实验是否有影响______(填“是”或“否”),请说明你的理由______.
(6)工业上用黄铜矿(CuFcS2)冶炼铜,副产品中也有SO2,冶炼铜的反应为:8CuFeS2+21O2
8Cu+4FeO+2Fe203+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是______.(填元素符号)当生成0.8mol铜时,此反应转移的电了数目是______.
参考答案:(1)该仪器是蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)酸性高锰酸钾有强氧化性,二氧化硫中硫元素是中间价态,有还原性,所以二氧化硫能被酸性高锰酸钾溶液氧化而褪色,同时说明二氧化硫有还原性,
故答案为:溶液颜色由紫色逐渐褪去;还原性;
(3)硫离子能被氧气氧化生成硫单质,离子反应方程式为:2S2-+O2+2H2O=2S↓+4OH-,故答案为:2S2-+O2+2H2O=2S↓+4OH-;
(4)二氧化硫具有漂白性,能使品红溶液褪色,但加热褪色后的品红溶液,溶液的颜色能复原,
故答案为:品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色;
(5)浓硫酸不能氧化亚硫酸钠,而浓硝酸能氧化亚硫酸钠生成硫酸钠,导致得不到二氧化硫,所以用浓硝酸对该实验有影响,
故答案为:是;浓硝酸可将亚硫酸钠氧化为硫酸钠,而得不到二氧化硫气体;
(6)反应8CuFeS2+21O2?高温?.?8Cu+4FeO+2Fe203+16SO2中铜元素、氧元素在得电子化合价降低,被还原;设转移电子数为x.
8CuFeS2+21O2?高温?.?8Cu+4FeO+2Fe203+16SO2 转移电子
?8mol? 100NA
? 0.8mol? x
x=10NA,故答案为:Cu、O;10NA.
本题解析:
本题难度:一般
5、选择题 下列实验过程中产生的现象与图中曲线变化相对应的是( )
A.
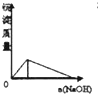
AlCl3滴入NaOH溶液
B.
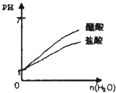
PH=1的醋酸和盐酸分别加水稀释
C.
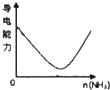
氨气通入醋酸溶液中
D.
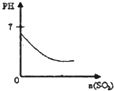
SO2气体通入溴水中
参考答案:D
本题解析:
本题难度:简单