1、简答题 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1mol?G可与1mol“您”恰好反应生成1mol?H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应.请回答下列问题:
(1)“京”是______,“欢”的同素异形体是______.
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:______,该反应为氧化还原反应,还原产物为______.
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中以得到一种化肥,写出该肥料的化学式:______.
(4)已知:P(s)+
Cl2(g)=PCl3(g);△H=-287.7kJ/mol,P(s)+Cl2(g)=PCl5(g);△H=-498.7kJ/mol.则PCl5(g)分解生成PCl3(g)和Cl2(g)反应的热化学方程式为:______.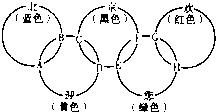
参考答案:由单质的颜色可知京为Fe,欢为P,迎为S,您为Cl2,C高温煅烧可制得A,A为SO2,B为SO3,P和Cl2反应可生成PCl3或PCl5,1mol?G可与1mol“您”恰好反应生成1molH,则G为PCl3,H为PCl5,Fe和Cl元素可组成FeCl2或FeCl3,题中告诉F的溶液与A反应生成酸M、酸N和E的溶液,说明F为FeCl3,E为FeCl2,S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,
(1)由以上分析可知“京”是铁,“欢”是红磷,对应的同素异形体是白磷,故答案为:铁;白磷;
(2)FeCl3具有氧化性,SO2具有还原性,二者发生氧化还原反应,
反应的方程式为2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2,由化合价的变化可知还原剂为FeCl2,
故答案为:2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2;FeCl2;
(3)S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,则C为FeS2,生成的SO2会污染大气,可用氨气处理,最终得到(NH4)2SO4,故答案为:(NH4)2SO4;
(4)已知:①P(s)+32Cl2(g)=PCl3(g)△H=-287.7kJ/mol,
②P(s)+52Cl2(g)=PCl5(g)△H=-498.7kJ/mol,
利用盖斯定律,将①-②可得PCl5(g)═Cl2(g)+PCl3(g)△H=(-287.7kJ/mol)-(-498.7kJ/mol)=+211.0kJ/mol,
故答案为:PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol.
本题解析:
本题难度:一般
2、推断题 如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均巳略去)
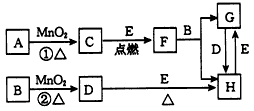
(1)写出下列物质的化学式B_________,E___________。
(2)指出MnO2在相关反应中的作用:反应①中是_______剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是_________(填化学式);若反应①是在常温条件下进行,则A是_________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为____________。
参考答案:(1)HCl;Fe
(2)催化;氧化
(3)KClO3;H2O2;2:1
本题解析:
本题难度:一般
3、填空题 中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为??,B体现出的化学性质有??
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为?
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,该反应中氧化剂与还原剂的物质的量之比为?
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在元素周期表中的位置是?
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量是?
参考答案:
(1)MnO2+4H++2Cl— Mn2++2H2O+Cl2↑?酸性和还原性
Mn2++2H2O+Cl2↑?酸性和还原性
(2)C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)涉及反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ,氧化剂与还原剂的物质的量之比为? 2:1
(4)①第四周期第Ⅷ族?②0.4a (各2分。
本题解析:(1)黄绿色气体一定为氯气,因此反应为:MnO2+4H++2Cl— Mn2++2H2O+Cl2↑ ,在这个反应中盐酸表现出来的性质为:酸性和还原性。
Mn2++2H2O+Cl2↑ ,在这个反应中盐酸表现出来的性质为:酸性和还原性。
(2)C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)2:1
(4)依题意可知:金属元素为Fe,①在周期表中的位置为:第四周期第Ⅷ族?
②? Fe?+? 2Fe3+?=? 3Fe2+
起始:Xmol? 2amol? 0
反应:bmol? 2bmol ?3bmol
最终:(x-b)mol? (2a-2b)mol? 3bmol
根椐题中提供条件:(2a-2b)= 3b,所以b=0.4a
因此被还原的Fe3+的物质的量为0.8a,那么被还原的X为0.4amol。
本题难度:困难
4、简答题 明明同学欲探究一块棕黑色块状固体的主要成分(仅由两种元素组成).将该固体溶于稀盐酸后,有气体A放出,并得到浅绿色溶液B.A在空气中充分燃烧,又得到无色有刺激性气味的气体C,该气体能使品红溶液褪色.向B溶液中加入过量的氢氧化钠溶液,可先得到白色沉淀,然后沉淀迅速变为灰绿色,最后变为红褐色.
根据上述实验现象回答:
(1)该棕黑色块状固体的主要成分是(写化学式)______.
(2)请另外写出两个有气体C生成的氧化还原反应方程式:
①______.
②______.
(3)请写出白色沉淀变成红褐色沉淀的化学方程式:______.
(4)将红褐色沉淀溶于稀盐酸后,欲检验溶液中的金属阳离子,可选用的试剂是______.
参考答案:将该固体溶于稀盐酸后,有气体A放出,并得到浅绿色溶液B,说明B中含有氯化亚铁,A在空气中充分燃烧,又得到无色有刺激性气味的气体C,该气体能使品红溶液褪色,则C是二氧化硫,A是硫化氢,向B溶液中加入过量的氢氧化钠溶液,可先得到白色沉淀,然后沉淀迅速变为灰绿色,最后变为红褐色,则说明B中溶质是氯化亚铁,棕黑色固体和盐酸反应生成氯化亚铁和硫化氢,则该棕黑色固体是FeS,
(1)通过以上分析知,A的化学式是FeS,故答案为:FeS;
(2)硫在氧气中燃烧生成二氧化硫,铜和浓硫酸在加热条件下反应生成二氧化硫,所以其方程式分别为:
S+O2?点燃?.?SO2,Cu+2H2SO4(浓)?△?.?CuSO4+SO2 ↑+2H2O,
故答案为:S+O2?点燃?.?SO2,Cu+2H2SO4(浓)?△?.?CuSO4+SO2 ↑+2H2O;
(3)氢氧化亚铁被氧气氧化生成氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,故答案为:KSCN溶液.
本题解析:
本题难度:一般
5、填空题 (16分)A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为?。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有??。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱, 写出其一级电离方程式:?。
写出其一级电离方程式:?。
②甲在碱性溶液中能够将CuO还原为Cu2O, 已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为?。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K?(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=?,YX2的平衡转化率为?。
参考答案:(16分)
(1)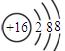 (1分)
(1分)
(2)离子键、共价键(2分)
(3)①N2H4 +H2O N2H5++ OHˉ (2分)
N2H5++ OHˉ (2分)
②N2H4 +4CuO=N2↑+2Cu2O+2H2O?(3分)
(4)2CO(g)+SO2(g)=2CO2(g)+S(s)?ΔH="–268.8" kJ·molˉ1 (3分)
(5)①不变(1分)
②1.6×103 ?80%或0.8(各2分,共4分)
本题解析:略
本题难度:简单