1、选择题 下列除去杂质的实验方法正确的是
A.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
B.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
C.除去FeC13酸性溶液中少量的FeC12:加入稍过量双氧水后放置
D.除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤
参考答案:C
本题解析:略
本题难度:简单
2、实验题 某同学设计如图所示实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题
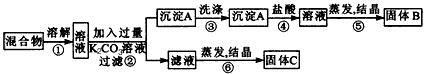
(1)B物质的化学式为_____________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是_______ (填序号)如何改进?
_____________________________________
?(3)写出②、④两步中对应的化学方程式:②_____________________, ④_______________________。
参考答案:(l)BaCl2
(2)⑥;先在滤液中加入过量的盐酸,以除去多余的CO32-,再进行蒸发结晶
(3)②BaCl2+K2CO3=BaCO3↓+2KCl;④BaCO3+2HCl=BaCl2+CO2↑+H2O
本题解析:
本题难度:一般
3、选择题 下列依据相关实验得出的结论正确的是
A.向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42-
B.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强
C.向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀。证明葡萄糖中不含醛基
D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液
参考答案:AB
本题解析:A、向溶液X中滴加盐酸无明显现象,排除了Ag+、CO32?、SO32?等离子的干扰,再滴加BaCl2溶液有白色沉淀,则X中含有SO42-,正确;B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,AlO2—结合了HCO3?中的H+,所以AlO2-结合H+能力比CO32-强,正确;C、制取新制氢氧化铜时,应该NaOH过量,错误;D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用硫氰化钾溶液,不能使用氯水,错误。
本题难度:一般
4、选择题 有A、B、C、D 四种物质,它们是Fe、稀HCl、NaOH溶液、AgN03溶液四种物质中的一种,它们的反应关系及反应类型如下,则物质B为(? )
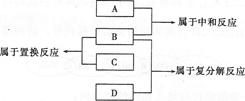
A.Fe? B.HCl(稀)? C.NaOH(溶液)? D.AgNO3(溶液)
参考答案:B
本题解析:本题的解答应该熟悉反应类型的定义。酸与碱反应属于中和反应,而金属单质与酸反应属于置换反应,由此可确定A为NaOH溶液,B为稀HCl,C为Fe,稀HCl与AgN03溶液的反应属于复分解反应,所以D为AgN03溶液。故选B。
点评:熟练掌握常见的反应类型,利用物质间相互反应的情况对物质进行鉴别。题目难度不大。
本题难度:简单
5、实验题 CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示
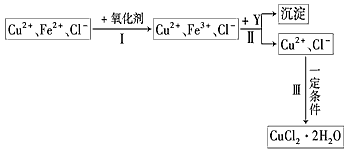
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为____________________。
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
________(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(3)步骤Ⅲ应控制的实验条件是________________________。
参考答案:(1)C;2Fe2++H2O2+2H+===2Fe3++2H2O
(2)C
(3)将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解
本题解析:
本题难度:一般