|
高考化学知识点整理《化学反应速率》考点预测(2017年强化版)(十)
2017-11-11 03:54:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 可逆反应:2SO2+O2 2SO3,用一定量的SO2和O2在容积固定的密闭容器内发生反应,如果v(SO2)=0.05 mol/(L·min),则2 min后SO3的浓度为 2SO3,用一定量的SO2和O2在容积固定的密闭容器内发生反应,如果v(SO2)=0.05 mol/(L·min),则2 min后SO3的浓度为
A.1 mol/L
B.0.9 mol/L
C.0.2 mol/L
D.0.1mol/L
|
参考答案:D
本题解析:可逆反应:2SO2+O2 2SO3,用一定量的SO2和O2在容积固定的密闭容器内发生反应,如果v(SO2)=0.05 mol/(L·min),故2 min后生成SO3的浓度为0.1mol/L,故D项正确。 2SO3,用一定量的SO2和O2在容积固定的密闭容器内发生反应,如果v(SO2)=0.05 mol/(L·min),故2 min后生成SO3的浓度为0.1mol/L,故D项正确。
考点:化学反应速率计算。
本题难度:一般
2、选择题 为探究Fe2+ 对O3氧化I-反应的影响,某研究小组测定两组实验中I3-浓度和体系pH,结果见以下图表。

下列说法不正确的是(? )?
A.在溶液中存在化学平衡I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为 I3-(aq),其平衡常数表达式为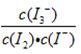
B.第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降。
C.3-18s内第2组实验中生成I3-的平均反应速率约为0.55 mol/(L·s)
D.Fe2+可作为O3氧化I-的催化剂
参考答案:C
本题解析:因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K= ,A选项正确;c(Fe3+)增加,发生反应:2Fe3++2I-=I2+2Fe2+,消耗I-,I2(g)不断生成,都会使I2(aq)+I-(aq) ,A选项正确;c(Fe3+)增加,发生反应:2Fe3++2I-=I2+2Fe2+,消耗I-,I2(g)不断生成,都会使I2(aq)+I-(aq) I3-(aq)平衡逆向移动,使c(I3-)急剧减小,B选项正确;3-18s内第2组实验中生成I3-的平均反应速率约为 I3-(aq)平衡逆向移动,使c(I3-)急剧减小,B选项正确;3-18s内第2组实验中生成I3-的平均反应速率约为 =0.55×10-3 mol/(L·s),C选项错误;由于是持续通入O3,O3可以将Fe2+氧化为Fe3+:O3+2Fe2++2H+=2Fe3++O2+H2O,Fe3+氧化I-:2Fe3++2I-=I2+2Fe2+,所以Fe2+可看作为O3氧化I-的催化剂,D选项正确。 =0.55×10-3 mol/(L·s),C选项错误;由于是持续通入O3,O3可以将Fe2+氧化为Fe3+:O3+2Fe2++2H+=2Fe3++O2+H2O,Fe3+氧化I-:2Fe3++2I-=I2+2Fe2+,所以Fe2+可看作为O3氧化I-的催化剂,D选项正确。
本题难度:一般
3、选择题 下列实验中,反应速率加快是由催化剂引起的是
[? ]
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量FeCl3,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快
参考答案:B
本题解析:
本题难度:简单
4、选择题 对于反应N2+O2 2NO在密闭容器中进行,下列哪些条件能加快反应的速率 2NO在密闭容器中进行,下列哪些条件能加快反应的速率
[? ]
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
参考答案:AB
本题解析:
本题难度:一般
5、实验题 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
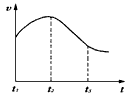
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是? ,t2~t3速率变化的主要原因是?
? ?
(2)实验二放出氢气量减少的原因是? ?。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。?
参考答案:(1)因为反应放热,溶液温度升高,反应速率加快;因为随反应进行,盐酸的浓度减小,反应速度减慢。
(2)因为Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少。
(3)正确。正极:铜;负极:锌;电解质溶液:盐酸。
本题解析:
本题难度:困难
|