|
高中化学知识点大全《水的电离平衡》试题特训(2017年最新版)(十)
2017-11-11 03:56:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:B
本题解析:酸中C(H+)越大,溶液的pH就越小。①是一元强酸,②是二元强酸,④是一元弱酸,③是一元强碱。当酸的浓度相等时,二元强酸的氢离子的浓度大于一元强酸的,一元强酸的大于一元弱酸的,碱中的氢离子浓度最小,因此C(H+)由大到小的顺序是②①④③ ,所以pH由小到大顺序排列②① ④ ③,选项是B。
考点:考查溶液中的pH 的大小排列顺序的知识。
本题难度:一般
2、选择题 水是生命之源,也是化学反应中的主角。请回答下列问题:
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为 。
Ⅱ.在许多反应中H2O扮演不同的“角色”。请结合所学知识,写出有关反应的化学方程式或离子方程式。
(1)H2O参与置换反应,符合X+W→Y+V:
已知X和Y分别是短周期主族元素形成的两种单质, W、V是化合物。
①W是水,作还原剂,该反应的化学方程为 ;
②V是水,化学方程式为 。
(2)水在氧化还原反应既不是氧化剂也不是还原剂:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
(3)某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5与水的反应描述正确的是 (填选项)。
A.NH5与水反应时,NH5是氧化剂
B.NH5与水反应时,NH5既是氧化剂又是还原剂
C.NH5与水反应时,NH5是还原剂
D.NH5与NH3溶于水后溶液均呈碱性
参考答案:I.H2O+H2O  OH- +H3O+(2分) OH- +H3O+(2分)
Ⅱ.(1)①2F2 +2H2O =O2 +4HF (2分) ②O2+2H2S=S+2H2O (2分)
(2)①Cl2 +H2O =" HCl" + HClO (2分) ②3NO2 +H2O = 2HNO3 + NO (2分)
(3)C D (2分,各1分)
说明:若所涉及的答案可能有多种,符合题意均给分。
本题解析:I.水电离生成电子总数相同的两种微粒,为OH?和H3O+。
Ⅱ.(1)①水做还原剂,应与比O2氧化性更强的F2反应,②H2O为产物,O2与H2S置换可生成H2O。
(2)高中化学学过的有颜色气体,能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,为Cl2和NO2。
(3)NH5为NH4H,NH4+与H?结合的离子化合物,与水反应时,H?化合价升高,H2O中的H化合价降低,生成H2和NH3, NH5为还原剂,H2O为氧化剂。
考点:本题考查水的电离、氧化还原反应以及物质的性质。
本题难度:困难
3、实验题 (11分)用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是
,此时溶液显 性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。]
滴定次数
| 待测溶液体积(mL)
| 标准酸体积
| 滴定前的刻度(mL)
| 滴定后的刻度(mL)
| 第一次
| 10.00
| 0.40
| 20.50
| 第二次
| 10.00
| 4.10
| 24.00
| 第三次
| 10.00
| 0.40
| 21.50
|
(4)分析下列实验操作会对滴定结果产生的影响。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果 。
参考答案:(1) (B) (2) 当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色 酸 (3) 0.4000 (4)① 偏高 ② 偏高 ③无影响 (各2分)
本题解析:(1)因为石蕊试液的颜色变化不明显,不便于观察,所以不能选用石蕊试液作指示剂。
(2)甲基橙的变色范围是3.1~4.4,即溶液是显酸性的。所以盐酸滴定碱液终点的变化是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色。
(3)三次实验中消耗盐酸的体积分别为20.10ml、19.90ml、21.10ml,所以第三次的实验误差大,所以取前2次的平均值,即盐酸的体积是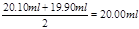 ,所以烧碱溶液的物质的量浓度是 ,所以烧碱溶液的物质的量浓度是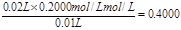 。 。
(4)开始俯视,则读数偏小,滴定终点平视,所以最终盐酸的体积偏大,结果偏高。锥形瓶用待测液润洗,则氢氧化钠的量偏多,消耗盐酸的体积偏大,结果偏高。烧碱溶液隔夜后滴定,则会含有杂质碳酸钠,但甲基橙的变色范围是在酸性环境中,所以根据原子守恒可知,消耗的盐酸是相同,不影响测定结果。
本题难度:一般
4、填空题 松花蛋与明朝初年问世,其腌制配方有多种,但主要配料为生石灰、纯碱和食盐.将一定比例的配料用水和黏土调成糊状,敷于蛋上,密封保存,数日后可食用.
(1)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有(不考虑粘土中物质可能参与的反应)?、?.
(2)松花蛋外的糊状物经溶解、过滤后,滤液中肯定含有的溶质为?和?,可能含有的溶质为Ca(OH)2?或Na2CO3.
(3)某同学设计下表的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案.
| 实验步骤 | 实验现象 | 实验结论
| ①取少量滤液,滴加适量K2CO3溶液
若出现白色沉淀
滤液中含Ca(OH)2
若无白色沉淀
滤液中无Ca(OH)2
②取少量滤液,
?
若出现?
滤液中含Na2CO3
|
(4)写出碳酸钠的电离方程式?.
参考答案:
本题解析:
本题难度:简单
5、选择题 下列四种溶液①pH=0的盐酸②0.1 kJ·mol-1的盐酸③0.01 kJ·mol-1的NaOH溶液 ④pH=11的NaOH溶液由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
| 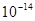 ,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为
,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为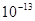 ,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为
,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为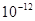 ,④pH=11的NaOH溶液由水电离出的氢离子浓度为
,④pH=11的NaOH溶液由水电离出的氢离子浓度为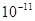 ,所以正确选项为A;
,所以正确选项为A;