| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《水的电离平衡》试题特训(2017年最新版)(八)
参考答案:B 本题解析:判断溶液酸碱性的根本依据是氢离子浓度和氢氧根离子浓度的相对大小,c(H+)>c(OH—) 的溶液是酸性溶液,而PH是在特定条件下的数值,在25℃时,PH<7的溶液是酸性溶液,选B。 本题难度:简单 3、填空题 实验表明,液态时纯硫酸的电离能力强于硝酸,纯硫酸的导电性也明显强于纯水。又知液态纯酸都像水那样进行自身电离H2O+H2O 参考答案:(1)2H2SO4 本题解析: 本题难度:一般 4、选择题 水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是 参考答案:B 本题解析: 本题难度:一般 5、选择题 HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是 |
参考答案:AB
本题解析:依题意,HA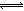 H++A—、H2O
H++A—、H2O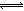 H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O
H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O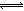 H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA
H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA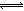 H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
考点:考查水溶液中粒子浓度大小关系,涉及弱酸溶液或弱酸与强碱混合溶液中的电荷守恒关系式、酸性的酸碱性、盐溶液中离子浓度大小顺序、弱酸电离平衡的移动规律、弱酸电离平衡常数的影响因素及规律等。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学实验的.. | |