| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《水的电离平衡》试题特训(2017年最新版)(四)
参考答案:C 本题解析:混合后溶液显碱性,pH等于12,c(OH-)=10-2 mol·L-1,设浓度为c mol·L-1,NaOH和HCl溶液体积分别为3VL、2VL,则有:(3Vc-2Vc)/5V=10-2 mol·L-1,得c="0.05" mol·L-1 本题难度:一般 2、选择题 某学生做中和滴定实验的过程如下: |
参考答案:B
本题解析:
试题解析:本题中c加入待测NaOH溶液之前必须用待测碱液润洗2—3次,否则残余蒸馏水会将碱液稀释,而使测得碱的浓度偏低。j步骤不正确,滴定时必须注视锥形瓶里的颜色变化,特别是滴液将达终点的颜色变化,应控制更慢滴液速度,以防过多。k不正确,酚酞变浅红色必须等待半分钟,如仍为粉红色表明已达终点,如果变为无色,说明未达真正终点,仍要加滴少量碱液。m不正确。两次重复操作得出数据的平均值应为小数点后两位才符合滴定管的精确度,如22.00 mL。所以,不正确的步骤是c.j.k.m。
考点:酸碱中和滴定
本题难度:一般
3、选择题 下列各式中,属于正确的电离方程式的是
[? ]
A.HCO3- + H2O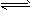 H2CO3 + OH-
H2CO3 + OH-
B.HCO3- +OH- ==== H2O + CO32-
C.NH3 + H+ === NH4+
D.NH3·H2O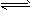 NH4+ + OH-
NH4+ + OH-
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列溶液一定呈中性的是
A.c (H+) × c(OH-) =10-14的溶液
B.n(H+)=n(OH—) 的溶液
C.c (H+)=1.0×10-7 mol/L的溶液
D.pH=3的酸与pH=11的碱等体积混合后的溶液
参考答案:B
本题解析:A、常温下的任何水溶液中都存在这个关系,没有说明氢离子和氢氧根离子浓度的关系,所以不能确定溶液的酸碱性,所以不选A;B、氢离子和氢氧根离子物质的量相等,说明浓度也相等,溶液显中性,所以选B;C、没有说明溶液是否在常温下,说明不能确定氢离子和氢氧根离子浓度的关系,就不能确定溶液的酸碱性,所以不选C;D、没有说明酸或碱的强弱,不能确定溶液的酸碱性,所以不选D。
考点:溶液的酸碱性。
本题难度:一般
5、选择题 下列说法正确的是
A.强电解质一定易溶于水
B.钢铁在海水中发生电化腐蚀时,铁是负极被氧化
C.对可逆反应,升高温度一定存在v(正)>v(逆)
D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小
参考答案:BD
本题解析:A.电解质的强弱一溶解度的大小无关,因此强电解质不一定易溶于水,错误;B.钢铁在海水中发生的电化腐蚀是吸氧腐蚀,铁作负极,失去电子,被氧化,错误;C.对可逆反应,升高温度,化学平衡向吸热反应方向移动,但是吸热反应不一定是正反应,所以不一定存在v(正)>v(逆) ,错误;D.相同浓度时,由于强酸电离产生的H+浓度大于弱酸,因此对水电离的抑制作用也大于弱酸,故强酸中水的电离程度比弱酸的水的电离程度小,正确。
考点:考查电解质的强弱与溶解性的关系、金属的电化学腐蚀、温度对可能反应的影响、强弱电解质对水电离程度的影响的知识。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学实验的.. | |