1、填空题 在四个无标签的试剂瓶中,分别盛有盐酸、Ba(OH)2 溶液、Na2CO3溶液、AgNO3
溶液。为了确定各瓶试剂,将它们分别编号为A、B、C、D,分别取样两两混合,其实验现象为:
A+B→无色气体? B+C→白色沉淀? A+D→白色沉淀? A+C→无明显现象
(1)由此推断各试剂瓶中所盛试剂为(填化学式)
A:??B:??C:??D:?
(2)写出下列反应的离子方程式
①A+C:?
②A+D:?
参考答案:(1) A? HCl??B Na2CO3?C Ba(OH)2 ?D? AgNO3
(2) ①A+C:H+ + OH-= H2O ?②A+D:Ag + + Cl-= AgCl↓
本题解析:略
本题难度:简单
2、填空题 (12分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
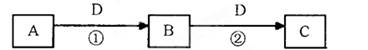
(1)若A可用于自来水消毒,D是生产、生活中用量大、用途广的金属单质,写出C转化为B的化学方程式为?;用A制漂白粉的反应方程式为?。
(2)若D与C60互为同素异形体,A与O3互为同素异形体,则C在高炉炼铁中的主要反应方程式为??。
(3)若D是空气质量预报要报的气体,相同条件下密度是氧气的两倍,A是烧碱溶液,则可以验证B是否变质的一组试剂是?(请写出试剂名称)。若已部分变质则实验现象为?。
(4)若A、B、C均为两种元素组成的非电解质且常温下均为气态,则反应①的化学方程式为?。
参考答案:

本题解析:(1)A 是Cl2;B 是FeCl3;C 是FeCl2;D 是Fe。
C转化为B的化学方程式为:2FeCl2+Cl2=2FeCl3
用A制漂白粉的反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)A是O2;B 是CO2;C 是CO;D 是C。
C在高炉炼铁中的主要反应方程式为:Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
(3) A是NaOH,B 是Na2SO3;C 是NaHSO3;D 是SO2。
验证B是否变质的一组试剂是盐酸和氯化钡溶液。若已部分变质则实验现象为:加入适量氯化钡溶液,有白色沉淀生成,再加过量盐酸,沉淀部分溶解且放出有刺激性气味的气体。
(4)A 是NH3;B 是NO;C是NO2;D 是O2。
反应①的化学方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
本题难度:简单
3、推断题 已知物质M由同一短周期的X、Y两种元素组成,X 原子的最外层电子数是其最内层电子数的一半,Y元素的最高正价与其最低负价的代数和为6。M与其他物质的转化关系如下所示(部分产物已略去)
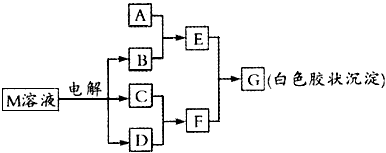
(1)工业电解M溶液的化学方程式为____________________
(2)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是第____周期第____族,写出A与B溶液反应的化学方程式____________________。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维。则该元素的原子结构示意图为
________,写出E与F反应的离子方程式____________________。
(4)B的电子式为____________,其中含有的化学键为____________。
(5)写出M物质的一种用途:________________。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)三;ⅢA;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3)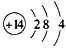 ;2H++SiO32-=H2SiO3↓
;2H++SiO32-=H2SiO3↓
(4)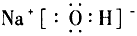 ;离子键和共价键
;离子键和共价键
(5)氯碱工业(答案合理均可)
本题解析:
本题难度:一般
4、推断题 马尔氏盐A为浅蓝绿色结晶,是一种重要的化学试剂,可用作聚合催化剂。A的溶液具有以下转化关系

回答下列问题:
(1)白色沉淀C的化学式为_____________,无色气体E的电子式为_________________。
(2)由D转化成为F的化学反应方程式为_________________。
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%。将其完全溶于水配成溶液,经过上述转化最多可得到的C和F的物质的量之比为2︰1。由此可确定A的化学式为_______________。
(4)上述转化关系中,若用稀硝酸代替稀盐酸,_________(填“能”或“不能”)通过该转化关系确定A的组成,理由是_______________________。要准确称出C的质量,需要重复进行干燥、冷却、称量的操作,目的是_____________________。
(5)A的标准溶液,常用于标定高锰酸钾溶液等。请写出在高锰酸钾溶液中滴加A的标准溶液时,所发生的离子反应方程式,并标明电子转移情况。________________________。
参考答案:(1)BaSO4;
(2)4Fe(OH)2+O2+2H2O = 4Fe(OH)3
(3)(NH4)2Fe(SO4)2·6H2O
(4)不能;因为不能确定它是硫酸盐还是亚硫酸盐;彻底除去C表面的水分
(5)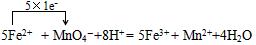
本题解析:
本题难度:一般
5、简答题 以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体.
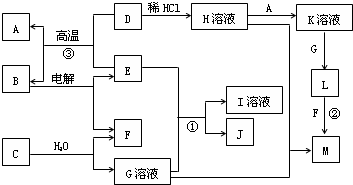
请回答下列问题:
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式______.
(4)写出①反应的离子方程式______.
(5)写出②、③反应的化学方程式②______,③______.
参考答案:C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;
D为红棕色粉末,为Fe2O3,M为红褐色固体,为Fe(OH)3,由D盐酸
本题解析:
本题难度:一般