1、选择题 下列各组物质仅用蒸馏水不能鉴别出的是( )
A.苯、酒精、硝基苯
B.食盐、烧碱、硝酸铵
C.蔗糖、硫酸铜粉末、碳酸钙粉末
D.氧化铜、二氧化猛、活性炭
参考答案:A.苯不溶于水,但密度比水小,酒精与水混溶,硝基苯不溶于水,但密度比水大,三者仅用蒸馏水就能鉴别出,故A不选;
B.烧碱溶于水放热,硝酸铵溶于水吸热,食盐溶于水温度没有明显的变化,可根据温度的变化鉴别三种物质,故B不选;
C.蔗糖溶于水,溶液呈无色,硫酸铜溶于水溶液呈蓝色,碳酸钙不溶于水,三者现象不同,可用水鉴别,故C不选;
D.氧化铜、二氧化猛、活性炭都为黑色粉末,都不溶于水,加水无法简便,故D选.
故选D.
本题解析:
本题难度:简单
2、选择题 下列实验能获得成功的是
A.苯和浓溴水用铁做催化剂制溴苯
B.将苯与浓硝酸混合共热制硝基苯
C.甲烷与氯气光照制得纯净的一氯甲烷
D.乙烯通入溴的四氯化碳溶液得到1,2—二溴乙烷
参考答案:D
本题解析:苯和液溴在催化剂的作用下,才能生成溴苯,A不正确。制取硝基苯需要浓硫酸作催化剂,B不正确。甲烷和氯气的取代反应生成物有5种,不可能得到纯净的一氯乙烷,不正确。乙烯分子中含有碳碳双键,和溴水发生加成反应,D正确。答案选D。
本题难度:简单
3、实验题 某学生利用以下装置探究氯气与氨气之间的反应。图中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
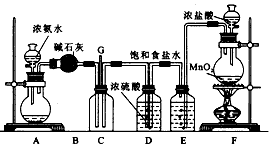
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用__________(选填序号)。
A.生石灰
B.碱石灰
C.五氧化二磷
D.烧碱
(2)装置F中发生反应的离子方程式为___________________________________。
(3)B装置的作用___________;E装置的作用___________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:____________________________________。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?___________________________________。
参考答案:(1)C
(2)
(3)干燥氨气;除去氯气中的氯化氢
(4)3Cl2+8NH3 = N2+6NH4Cl或3Cl2+2NH3 = N2+6HCl;NH3+HCl = NH4Cl
(5)在G连接导管,直接把尾气通入盛有烧碱溶液的烧杯中
本题解析:
本题难度:一般
4、实验题 (13分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
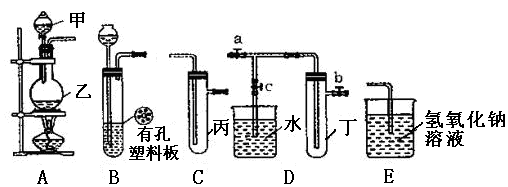
(1)甲、乙两仪器的名称是 、 。
(2)利用B装置可制取的气体有 (写出两种即可)。
(3)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 ?mol·L?1(保留2位有效数值,气体按标准状况计算)。
参考答案:(13分)
(1) 分液漏斗、圆底烧瓶(2分)?
(2)H2、CO2 、 H2S等?(2分)
(3)4HCl(浓)+ MnO2 ?MnCl2 + Cl2↑ + 2H2O (3分)
?MnCl2 + Cl2↑ + 2H2O (3分)
(4)①a、b(2分);? c(1分)? ② 0.045?(3分)
本题解析:B装置的特征是有空的隔离板,还有长颈漏斗,相当于是简易的启普发生器,所以可以制取H2、CO2 、 H2S等;A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程是4HCl(浓)+ MnO2 ?MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L?1具体的计算过程是:
?MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L?1具体的计算过程是:
4NO2+O2+2H2O==4HNO3
假设试管体积是v,所以溶液体积也是v,二氧化氮体积也是v,所以由公式得:n(NO2)=n(HNO3)=v/22,4? mol? c(HNO3)=n(HNO3)/v? ="1/22.4" ="0.045" mol/L2的性质实验
点评:本题重点考查的是NO2的性质实验,学生只要熟练掌握试验的分析方法和与物质的量有关的计算方法,此类问题不难解决。
本题难度:一般
5、实验题 (10分)为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中。下图是本实验所需的仪器和药品:图中A.B.C.D.E.F分别表示玻璃导管或仪器接口。

请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号);D从E处插入烧瓶后,_____________接_____________,_____________接_____________。
(2)写出制备 的反应方程式:______?。
的反应方程式:______?。
某学生用含0.4molHCl的浓盐酸和足量MnO2反应制 得到的
得到的 总小于
总小于 (标况下)为什么?___________________?
(标况下)为什么?___________________?
(3)实验完成后,装置1中的溶液为_____________色,再向其中滴加足量 溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______? .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______? .
(4)工业上,可用 制备漂白粉,请写制备漂白粉的离子反应方程式:
制备漂白粉,请写制备漂白粉的离子反应方程式:
____________??。
参考答案:(10分)?
(1)(2分)F.B.A.C
(2)(2分)
浓盐酸随着反应的进行浓度变稀后,将不再反应, 浓盐酸具有挥发性。(1分)
(3)(3分)蓝?是?吸收剩余的Cl2
(4)(2分)
本题解析:略
本题难度:简单