1、实验题 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热来源:91考试网 91ExAm.org液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 硫的质量确定:
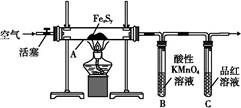
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.1 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
滴定次数
| 待测溶液
体积/mL
| 草酸溶液体积/mL
|
滴定前刻度
| 滴定后刻度
|
1
| 25.00
| 1.50
| 23.70
|
2
| 25.00
| 1.02
| 26.03
|
3
| 25.00
| 0.00
| 24.99
|
相关反应:①2Mn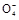 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S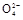 +4H+
+4H+
②2Mn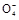 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
【实验Ⅱ】 铁的质量确定:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是?。
(2)滴定终点的判断方法是?。
(3)试管C中品红溶液的作用是?。
有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是?。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为?。
【问题探究】 滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号
| 温度/℃
| 酸化的H2C2O4
溶液/mL
| KMnO4
溶液/mL
| 溶液褪
色时间/s
|
1
| 25
| 5.0
| 2.0
| 40
|
2
| 25
| 5.0(另加少量可溶
于水的MnSO4粉末)
| 2.0
| 4
|
3
| 60
| 5.0
| 2.0
| 25
|
?
(5)分析上述数据,滴定过程中反应速率较快的一种可能原因是?。
2、实验题 14、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是:
①用天平称量NaOH固体时,将NaOH放在右盘,砝码放在左盘,并移动游码使之平衡。
②滴定前有气泡,滴定终点无气泡。
③用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定。
④用蒸馏水洗净酸滴定管后盛入标准盐酸进行滴定。
⑤滴定终点读取酸滴定管数据时,仰视刻度线。
3、实验题 (13分)在标准状况下,将224LHCl气体溶于635mL水中(水的密度为1 g/cm3)
所得盐酸的密度为1.18g/cm3,回答下列问题:
(1)该盐酸溶液的质量分数为?;该盐酸溶液的物质的量浓度为?。
(2)实验室利用该盐酸来配制250mL0.5mol/L的稀盐酸,从下列用品中选出实验所需要的仪器或用品______________(填序号)
a .胶头滴管?b.10mL量筒?c.20mL量筒 ?d. 100mL容量瓶?
.胶头滴管?b.10mL量筒?c.20mL量筒 ?d. 100mL容量瓶?
e.玻璃棒?f.1000mL容量瓶? g.广口瓶 ?h.托盘天平
除选用上述仪器外,尚缺少的仪器或用品是__? ______。需取用原盐酸?mL。
(3)下列操作对所配溶液的浓度有何影响?(答偏高、偏低、无影响)
①转移一次后,将洗涤烧杯的残液倒入废液缸中:?。
②定容时仰视容量瓶:?。
③定容后,加盖倒转摇匀后观察,发现液面低于刻度线:? ?。
?。
4、填空题 现对0.1 mol/L的纯碱溶液进行相关研究。
(1)用pH试纸测定该溶液的pH,其正确的操作?
?。
(2)纯碱溶液呈碱性的原因是(用离子方程式表示)??。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32—离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。?
?。
(4)某同学根据所学知识对溶液进行分 析,写出了以下四个关系式。请你判断:在正确的关系式后面打“
析,写出了以下四个关系式。请你判断:在正确的关系式后面打“ ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。
① c()=?2[c(2-3 )+c(HCO-3 ) ]:?;
② c()+c(H+)= ?2?c(2-3 )+c(HCO-3 )+c(OH-):?;
③ c(OH-)=?c(H+)+c(HCO-3 ) +c():?;
④ c()>c(2-3 )>c(OH-)>c(HCO-3 ) :?。
5、实验题 (14分)滴定法是化学研究中常用的定量实验方法。
⑴某化学兴趣小组用已知浓度的硫酸滴定未知浓度的氢氧化钠溶液测定其浓度。
①实验中应选用的指示剂为?。
②下列操作导致测定结果偏高的有?。
a.酸式滴定管用蒸馏水润洗后未用硫酸润洗
b.锥形瓶用蒸馏水润洗后未用待测氢氧化钠溶液润洗
c.酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失
⑵莫乐法是一种沉淀滴定法.测定某溶液的的c(Cl-),以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液[Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是?。
②该滴定适宜的pH范围是6.5~10.5,若溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2,。下列有关说法你认为正确的有?。
a.若溶液pH<6.5,则平衡Cr2O72-+H2O 2CrO42-+2H+左移,导致滴定终点滞后。
2CrO42-+2H+左移,导致滴定终点滞后。
b.若溶液中有铵盐存在,当pH>7.2时,则因可能生成[Ag(NH3)2]+,导致终点滞后。
c.滴定时应剧烈摇动,促使被AgCl沉淀吸附的Cl-及时释放出来,防止滴定终点滞后。
⑶氧化还原滴定是水环境监测的常用方法可用于测定废水中的化学耗氧量(单位mg/L——每升水样中还原性物质被氧化需O2的质量)。某兴趣小组每次取100mL废水,用硫酸酸化后,加入0.01667mol/LK2CrO7溶液25.00mL,使水样中的还原性物质完全氧化,然后用0.1000mol/LFeSO4标准溶液滴定剩余的Cr2O72-。实验数据记录如下:
实验序号
| FeSO4溶液的体积读数/mL
|
滴定前
| 滴定后
|
1
| 0.10
| 16.20
|
2
| 0.30
| 15.31
|
3
| 0.20
| 15.19
|
试回答下列问题:
①___Cr2O72-+____Fe2++____ ________==_____Cr3++_____Fe3++____H2O
②计算该废水的化学耗氧量。(写出计算过程,结果保留一位小数。)