1、选择题 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
参考答案:X、Y原子的最外层电子数相同,说明位于同一主族,X的原子半径小于Y,则原子序数Y大于X,则:
A.如X、Y为金属元素,同主族元素从上到下元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,故A正确;
B.若HnXOm为硝酸,则X的氢化物为氨气,为碱性气体,溶于水呈碱性,故B错误;
C.若X形成的单质是N2,则Y元素形成的单质可以是红磷或者白磷,白磷的分子式为P4,故C错误;
D.若Y的最高正价为+m,X不一定有正价,如Cl的最高正价为+7价,而F的最高价为0价,故D错误.
故选A.
本题解析:
本题难度:一般
2、简答题 已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元素,B元素的原子核外M层上的电子数比K层上的电子数多1.
(1)A原子的结构示意图为______;A元素在周期表中位置为______.
(2)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式______.
(3)A和C形成的化合物的电子式为______,该化合物的水溶液呈______性(填“酸”或“碱”).
(4)A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是______.A、B、C三元素形成简单离子的半径大小顺序为______.(用离子符号表示)
(5)比较A、B单质活泼性的实验方法是______.
参考答案:A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为40,故C的原子序数为40-11-13=16,故C为S元素
(1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为
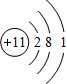
;Na元素在周期表中位置为第三周期第ⅠA族.
故答案为:
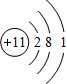
;第三周期第ⅠA族.
(2)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(3)A和C形成的化合物是Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为

;硫化钠溶液中硫离子水解,使溶液呈碱性.
故答案为:

;碱.
(4)同周期元素中Na元素原子的核电荷数最小,对最外层电子的引力越强,原子半径最大;最外层电子数相同电子层越多离子半径越多,电子层结构相同核电荷数越多离子半径越小,故离子半径S2->Na+>Al3+.
故答案为:电子层相同,核电荷数越小,对最外层电子的引力越,原子半径越大;S2->Na+>Al3+.
(5)利用金属钠与去掉氧化膜的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼.
故答案为:利用金属钠与去掉氧化镁的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼.
本题解析:
本题难度:一般
3、选择题 核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.核电荷数为17的元素容易失去1个电子
参考答案:A.氢元素原子最外层由1个电子,属于非金属性,故A错误;
B.氦元素原子只有2个电子,属于非金属性,故B错误;
C.原子核外各层电子数相等的元素是Be元素,是金属元素,故C正确;
D.核电荷数为17的元素是Cl元素,容易获得1个电子形成氯离子,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是
[? ]
A.H2O
B.BF3
C.CCl4
D.PCl5
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知X、Y、Z、T四种非金属元素,X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X,氢化物的稳定性是HX>HT,原子序数T>Z,其稳定结构的离子核外电子数相等,而其离子半径是Z>T.四种元素的非金属性从强到弱排列顺序正确的是( )
A.X、Y、Z、T
B.Y、X、Z、T
C.X、Y、T、Z
D.Y、X、T、Z
参考答案:D
本题解析:
本题难度:简单