1、选择题 海水中含量最多的离子是( )?
A.钠离子
B.氯离子
C.钙离子
D.镁离子
参考答案:B
本题解析:由于海水大量存在氯化钠和其他金属氯化物,所以海水中含量最多的离子是氯离子。
本题难度:一般
2、简答题 I.现有以下物质:①Cu;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤CuSO4;⑥固体NaOH;⑦CaO.
请回答下列问题(用序号填写):
其中:(1)能导电的是______(2)属于强电解质的是______(3)属于非电解质的是______
II.(1)胶体粒子的大小在______之间,可利用______(填物理性质)区别Fe(OH)3胶体和碘水.
(2)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为______,硫原子和氧原子个数之比为______.
(3)漂白粉是用Cl2与______(填化学式)反应来制取的,漂白粉是______(填“混合物”或“纯净物”),其有效成分为______,84消毒液的有效成分是______(以上两空均填化学式).
参考答案:I(1)Cu是金属单质,有能导电的自由电子;熔融的KNO3有自由移动的离子,能导电,故答案为:①④;
(2)熔融的KNO3;CuSO4;固体NaOH;CaO,能完全电离,属于强电解质,故答案为:④⑤⑥⑦;
(3)液态SO3的水溶液能导电,原因是SO3和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子而使溶液导电,硫酸是电解质,SO3是非电解质;乙醇(C2H5OH)在水溶液里或熔融状态下都不能导电的化合物,属于非电解质,故答案为:②③;
II.(1)当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),Fe(OH)3胶体有丁达尔效应和碘水无丁达尔效应,故答案为:1-100nm;丁达尔现象;
(2)根据n=mM,SO2和SO3的物质的量之比为464:580=1:1,硫原子和氧原子个数之比为2:5,故答案为:1:1;2:5;
(3)漂白粉的制取原理为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;氢氧化钠溶液与氯气反应生成NaClO、NaCl、H2O,反应的化学方程式为:Cl2+2NaOH═NaClO+NaCl+H2O,
故答案为:Ca(OH)2;混合物;Ca(ClO)2;NaClO.
本题解析:
本题难度:一般
3、选择题 下列说法中不正确的有( )
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③燃煤时加入适量石灰石,可减少废气中SO2的量;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化.
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤.
A.2个
B.3个
C.4个
D.5个
参考答案:①氯气和烧碱、石灰乳都能生成次氯酸盐,次氯酸盐具有强氧化性,能杀菌消毒,故正确.
②氯水中含有次氯酸,次氯酸不稳定见光易分解生成氯化氢和氧气,所以逸出的气体是氧气,故错误.
③高温条件下,二氧化硫能和碳酸钙反应生成亚硫酸钙和二氧化碳,所以能减少二氧化硫的排放,故正确.
④正常雨水的PH=5.6,酸雨的PH值小于5.6,故错误.
⑤室温下,浓硫酸与铜片不反应,故错误.
⑥氯气易液化,液氯中不含氢离子,导致不和铁反应,所以可以保存在钢瓶中,故正确;
⑦常温下,浓硫酸和铝发生钝化现象,所以浓硫酸可以用铝制容器盛放,故正确;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质是二氧化锰,二氧化锰能和浓盐酸反应但不和稀盐酸反应,所以不能用稀盐酸洗涤,故错误.
故选C
本题解析:
本题难度:一般
4、选择题 已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
[? ]
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
参考答案:B
本题解析:
本题难度:简单
5、填空题 (4分)以下是实验室制取氯气的装置,在图中饱和食盐水的作用是?,
浓硫酸的作用是?,F中盛放的溶液是?,起的作用是?。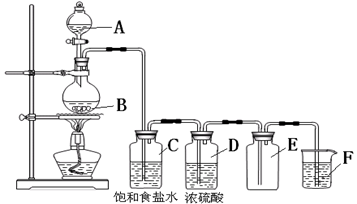
参考答案:吸收氯化氢;干燥;氢氧化钠溶液;吸收尾气
本题解析:考查氯气的制取、净化及收集及尾气处理
制氯气的反应原理为MnO2+4HCl(浓)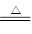 MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,在所制气体中含有HCl及水蒸气,一般用饱和食盐水来吸收HCl,用浓硫酸来吸收水蒸气,最后用碱液来吸收过多的氯气,以防污染空气:2Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,在所制气体中含有HCl及水蒸气,一般用饱和食盐水来吸收HCl,用浓硫酸来吸收水蒸气,最后用碱液来吸收过多的氯气,以防污染空气:2Cl2+2NaOH=NaCl+NaClO+H2O
本题难度:简单