1、选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。则下列有关说法中,不正确的是
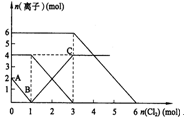
A.还原性:I— >Fe2+>Br—
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
参考答案:B
本题解析:
两个基本反应为:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.
A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6mOl降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选B.
本题难度:一般
2、填空题 浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:?。
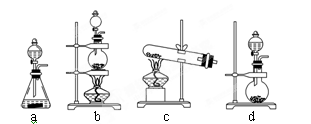
(2)实验室用二氧化锰制取氯气的化学方程式为:?;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?(填写装置的序号)。
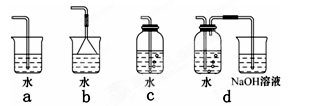
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:?;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是?(选填下列选项的编号字母)。
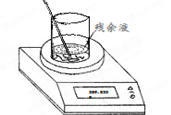
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
CaCO3用量
| 未加CaCO3时
| 加约四分之一时
| 加一半时
| 全部加完时
|
读数/g
| 318.3
| 325.3
| 334.5
| 359.5
|
请你据此分析计算:
①实验中产生的CO2气体质量为?;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位)?。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(2)MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑(2分);b(1分)
MnCl2+2H2O+Cl2↑(2分);b(1分)
(3)2Br-+Cl2=2Cl-+Br2(2分);d(1分) (4)①8.8g(2分);②4.0mol/L(3分)
本题解析:(1)“氯碱工业”是以食盐水为原料,通过电解法制取Cl2等物质,有关的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)实验室用二氧化锰制取氯气的化学方程式为MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
(3)氯气的氧化性强于单质溴的,能把溴离子氧化生成单质溴,所以Br—→Br2的转化离子方程式为2Br-+Cl2=2Cl-+Br2。氯气能溶于水,但溶解度很小。另外氯气有毒,需要尾气处理,可以用氢氧化钠溶液吸收,因此正确的答案选d。
(4)①根据质量守恒定律可知,反应中产生CO2的质量=318.3g+50.0g-359.5g=8.8g。
②CO2的物质的量=8.8g÷44g/mol=0.2mol,则根据方程式可知
CaCO3+2HCl=CaCl2+H2O+CO2↑
2mol? 1mol
0.4mol? 0.2mol
所以盐酸的浓度=0.4mol÷0.1L=4.0mol/L
本题难度:一般
3、实验题 某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。

(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
参考答案:(1)H→B、A→C、D→E (2分)饱和食盐水(2分)
(2)2NaCl + MnO2 +2 H2SO4 = MnSO4 + Na2SO4 + 2H2O + Cl2↑(加热) (2分)
(3)①BaCl2(1分) KOH (1分)
②足量的新制氯水 (2分)
(4)①SCN-(1分)
②HNO3过量,没有Fe2+剩余 (1分)
③NO2、CO2、N2(3分)
④少量(1分)
本题解析:
试题分析: (1)制备气体的仪器连接遵从发生装置→除杂装置→干燥装置→收集→尾气吸收的顺序,考虑制备氯气中含有HCl和水蒸气等杂质气体,所以先用排饱和食盐水法除去HCl,再用浓硫酸吸收水蒸气,再用向上排空气法收集,用碱吸收尾气,满足该顺序,连接应为H→B、A→C、D→E,所以根据顺序可以得知广口瓶Ⅱ中的试剂为饱和食盐水。
(2)根据图中的发生装置可知,该实验中采用了难挥发的硫酸制备挥发性的盐酸,再与二氧化锰制备氯气的方法,所以方程式为2NaCl + MnO2 +2 H2SO4 = MnSO4 + Na2SO4 + 2H2O + Cl2↑(加热)。
(3)①氯化钾中含有Fe3+、SO42-、Br-等杂质离子,其中加入的试剂是NH3.H2O可以使Fe3+ 沉淀除去,除去SO42- 需要加入Ba2+试剂,使之转化为BaSO4沉淀除去,为了不引入过多杂质,应选用阴离子相同的BaCl2 ;为了把NH4+除去,可以加入强碱KOH,所以步骤a中依次加入的试剂是NH3.H2O、 BaCl2 、KOH。②步骤c中除去的是杂质Br- ,所以加入新制氯水,把Br- 转化为单质Br2除去。
(4)①甲同学已经假设是FeSO4与HNO3作用 ,所以根据提供的资料可以猜测导致实验现象的可能是SCN-和硝酸作用的结果,所以乙同学假设是SCN-与HNO3作用。
②如果按照甲同学的假设分析,FeSO4与HNO3作用只会导致Fe2+被氧化为Fe3+最终和KSCN作用使溶液变红,且加入的浓HNO3过量,不会出现溶液显红色后又变成蓝色,所以甲同学假设不成立。
③根据乙同学的假设,造成实验现象的是浓HNO3和KSCN溶液作用的结果。根据物质中的元素组成分析,浓硝酸生成红棕色气体NO2,SCN-中产生的能使Ba(OH)2溶液产生浑浊现象的气体不可能是SO2,因为SO2容易被强氧化剂氧化,所以只可能是CO2,而S被氧化为SO42-在反应后的溶液中,所以加入BaCl2溶液能产生白色沉淀;剩余的空气主要成分的气体是N2,所以产生的气体依次是NO2、CO2、N2 。
④用SCN-间接检验Fe2+时,需要加入强氧化剂把Fe2+氧化才会出现无色变红色现象,但是根据上述中的实验经历,如果强氧化剂过量容易把用SCN-氧化,使溶液红色消失变成蓝色。根据资料提供显示氧化性Cl2 >(SCN)2?,所以氯气过量同样能氧化SCN- ,造成红色消失变成蓝色的现象,所以加入氧化剂的量必须要少量。
本题难度:一般
4、选择题 下列实验现象的描述错误的是
A.氢气在氯气中燃烧产生苍白色火焰
B.红热的铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒
C.红热的铜丝在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
参考答案:B
本题解析:铁在氯气中燃烧,反应非常剧烈,但是生成的不是黑色固体,是产生大量棕褐色的烟,所以B项错误,其余均正确。
本题难度:一般
5、选择题 下列反反应发生时,会产生红棕色烟的是( )
A.钠在氯气中燃烧
B.铜在氯气中燃烧
C.氢气在氯气中燃烧
D.铁在氯气中燃烧
参考答案:A、钠在氯气中燃烧生成固体氯化钠,观察到白烟,故A不选;
B、铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,故B不选;
C、氢气在氯气中燃烧生成气体HCl,在集气瓶口观察到白雾,故C不选;
D、铁在氯气中燃烧生成固体氯化铁,观察到红棕色烟,故D选;
故选D.
本题解析:
本题难度:一般