1、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
T℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
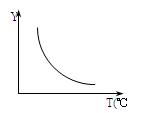
(1)该反应正向为ΔH 0;若该反应符合下图所示的关系,则在图中,Y轴是指 。
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆” ),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol/L和0.100 mol/L,平衡时CO的转化率 。
参考答案:(1)>(1分);CO2或H2的百分含量(1分)(其它合理答案也给分)
(2)b、c (漏选、多选、错选均不得分,2分)
(3)800℃; 正; 不变; 不变(各1分)
(4)33.3%(2分)
本题解析:略
本题难度:一般
2、选择题 下列物质中,含有共价键的化合物是
A.碘化氢
B.烧碱
C.液溴
D.食盐
参考答案:AB
本题解析:试题分析:一般非金属元素的原子之间容易形成共价键,所以A中的I和H之间,B中的O和H之间都含有共价键;C中含有共价键,但不是化合物;D中含有离子键,答案选AB。
考点:考查化学键的有关判断
点评:本题属于会出现试题的考查,也是高考中的常见题型。该提容易错选C,主要是审题不清导致的,所以正确的审题是答题的关键。本题有利于培养学生的答题能力。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.过量二氧化碳通人偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
B.漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.亚硫酸氢铵溶液与等物质的量的NaOH溶液混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
D.在碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
参考答案:A
本题解析:分析:A、过量二氧化碳和偏氯酸钠溶液反应生成氢氧化铝和碳酸氢钠;
B、次氯酸具有氧化性能氧化二氧化硫为硫酸;
C、亚硫酸氢铵溶液与等物质的量的NaOH溶液混合,先中和反应;
D、酸式盐和碱反应,量少的全部反应.
解答:A、过量二氧化碳通人偏铝酸钠溶液中,过量二氧化碳和偏氯酸钠溶液反应生成氢氧化铝和碳酸氢钠:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-,故A正确;
B、漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO4↓+2H++2Cl-,故B错误;
C、亚硫酸氢铵溶液与等物质的量的NaOH溶液混合:HSO3-+OH-=SO32-+H2O,故C错误;
D、在碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++4OH-=CaCO3↓+2H2O+Mg(OH)2↓,故D错误;
故选A.
点评:本题考查了离子方程式书写方法和注意问题,掌握基础是解题关键,题目难度中等.
本题难度:简单
4、填空题 (12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,若Na2CO3溶液的浓度为2×10—4mo1/L,现将等体积的CaCl2溶液与Na2CO3溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mo1/ L。
(4)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子的空间构型是_____,中心碳原子的轨道杂化类型为_____。1 mol甲醛分子中σ键的数目为________。
②甲醇可制作燃料电池,以KOH溶液作电解质,向两极分别充入甲醇和空气,工作过程中,负极反应方程式为:___________________。
③已知在常温常压下:
CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ? △H=" -556.0" kJ·mol-1
H2O(g)=H2O(l)? △H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1)1s22s22p63s23p63d104s2
(2)C≡O (3)5.6×10—5
(4)①甲醇分子之间形成氢键,平面三角形,sp2杂化,1.806×1024
②CH3OH-6e-+8OH-=CO32-+6H2O ③CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l)△H=-725.8kJ/mol
本题解析:(1)Zn的原子序数为30,关键是要注意3d轨道写在4s轨道的前面,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:N≡N,互为等电子体分子的结构相似,可写出CO的结构式为C≡O,故答案为:C≡O;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)×c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸
点高;甲醛为sp2杂化,不含孤电子对,分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳
氢δ键,1mol碳氧δ键,故含有δ键的物质的量为3mol,数目为1.806×1024个;②正极得到电子,
发生还原反应,同时因为在碱性条件下,则OH-参与反应,根据总方程式可知产物是CO32-和6H2O所以答案为:CH3OH-6e-+8OH-=CO32-+6H2O③根据盖斯定律得 :热方程式1+热化学方程式2×1/2+热化学方程式3×2 则答案为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
考点:考查共价键类型和热化学方程式书写等相关知识点
本题难度:困难
5、选择题 下列物质中,既有离子键,又有共价键的是
A.H2O
B.He
C.MgCl2
D.Na2O2
参考答案:D
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知A~D中含有的化学键分别是极性键、不含化学键、离子键、离子键和非极性键。答案选D。
本题难度:简单