1、选择题 反应2A(g)?2B(g)+E(g)-Q,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压
B.减压
C.增加E的浓度
D.降温
参考答案:A.增大压强,平衡向逆反应方向移动,A的浓度增大,但正、逆反应速率都增大,故A错误;
B.降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B错误;
C.增大E的浓度,平衡向逆反应方向移动,A的浓度增大,瞬间逆反应速率增大、正反应速率不变,随后逆反应减小、正反应速率增大,故C错误;
D.正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小,A的浓度增大,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 现向一密闭容器中充入1molN2和3molH2,在一定条件下发生如下反应:N2+3H2?2NH3,下列有关说法错误的是( )
A.若加入催化剂,可以使反应速率加快
B.若减小压强,可以使反应速率减慢
C.反应达到平衡后,有2molNH3生成
D.反应达到平衡后,各物质的物质的量浓度不再发生变化
参考答案:A.催化剂降低反应的活化能,反应速率加快,故A正确;
B.对于气体参加的反应,减小压强,反应物的浓度减小,反应速率减小,故B正确;
C.反应为可逆反应,反应物的转化率不可能达到100%,1molN2和3molH2反应,生成的氨气的物质的量小于2mol,故C错误;
D.达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,故D正确.
故选C.
本题解析:
本题难度:一般
3、选择题 对于平衡体系mA(g)+nB(g)?pC(g)+qD(g)△H<0.下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol
D.保持其它条件不变,升高温度,平衡向正反应方向移动
参考答案:A、若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,说明平衡逆向进行,逆向是气体体积减小的反应,m+n<p+q,故A正确;
B、若平衡时,A、B的转化率相等,转化率是转化量除以起始量计算,说明反应开始时,A、B的物质的量之比为m:n,故B正确;
C、若m+n=p+q,明反应前后气体体积不变,气体物质的量不变,则向含有a mol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,故C正确;
D、保持其它条件不变,升高温度,平衡向逆反应方向移动,故D错误;
故选D.
本题解析:
本题难度:简单
4、简答题 在真空密闭容器中盛有1mol PCl5发生反应PCl5(气)?PCl3(气)+Cl2(气)达平衡后,PCl5所占体积分数为a%,若在同一温度和同一容器中,最初投入的是3mol?PCl5,反应达平衡,PCl5体积分数为b%,则a?b关系正确的是( )
A.a大于b
B.a小于b
C.a等于b
D.无法比较
参考答案:根据PV=nRT知,R为常数,当V、T相同时,n越大,P越大;该反应是气体体积增大的反应,3mol>1mol,则增大压强,平衡向气体体积减小的方向移动,即逆反应方向移动,所以导致反应达到平衡时PCl5的转化率减小,PCl5的体积分数增大,故a<b.
故选B.
本题解析:
本题难度:一般
5、选择题 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)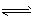 1/2N2(g)+CO2(g) ΔH =-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
1/2N2(g)+CO2(g) ΔH =-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
[? ]
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
参考答案:B
本题解析:
本题难度:一般