|
|
|
高考化学知识点总结《化学反应速率》高频试题强化练习(2017年最新版)(二)
2017-11-11 04:18:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:D
本题解析:由图像可知,反应物的能量比生成物的能量低,反应吸热,A错误;催化剂不能改变反应的焓变,B错误;逆反应的活化能E2小于正反应的活化能E1,C错误;由图像可知,催化剂能降低反应的活化能,正确;答案选D。
考点:反应热与活化能
本题难度:一般
3、填空题 (11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g)?CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g)?CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) ?CH3OH (g)+H2(g)的△H= kJ·mol-1。
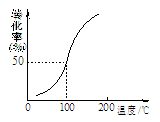
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。
(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的 ,对平衡体系产生的影响是 (填序号)。 ,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小, 减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
参考答案:(1)(2分)+77.0 (2)0.03 (3)②③
(4)①Co2+-e-= Co3+(或6Co2+-6e-=6Co3+) ②6 H2O 6
本题解析:(1)根据盖斯定律,反应CH4(g)+H2O(g)?CH3OH (g)+H2(g)将①+②可得,则△H=(+206.0KJ/mol)+(-129.0KJ/mol)=-77KJ/mol;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O (g)="CO" (g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平衡反应速率V(H2)= ="0.03" mol?L-1?min-1; ="0.03" mol?L-1?min-1;
(3)在一定条件下,将一定量的CO和氢气的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查电化学基础、化学平衡的影响因素。
本题难度:困难
4、选择题 一定能使化学反应NaOH+HCl====NaCl+H2O速率加快的方法是( )
(a)升温 (b)减小生成物浓度 (c)增加反应物浓度 (d)加压
A.(a)(b)和(c)
B.(a)和(c)
C.(b)和(d)
D.全部
|
参考答案: B
本题解析: 由于改变压强对没有气体参加的反应的速率是不会产生影响的,所以应该选B
本题难度:一般
5、选择题 在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)  ?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
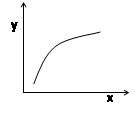
A.若平衡常数K值变大,平衡移动时v逆先减小后增大
B.容器中固体物质的质量不再改变,则反应到达平衡状态
C.若x表示温度,y可表示平衡时混合气体的密度
D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比
参考答案:BC
本题解析:该反应为正方向体积增加且吸热,A.若平衡常数K值变大,平衡右移,v逆增大,错误;B.容器中固体物质的质量不再改变,说明生成量和消耗量相等,则反应到达平衡状态,正确;C、升高温度,平衡正向移动,气体的质量增加,密度增大,正确;增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故D错误;
本题难度:一般
 ?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是