1、选择题 下列叙述不正确的是(?)
A.在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.在12g金刚石晶体中,含共价键为2NA
参考答案:B
本题解析:金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有6个碳原子,B错。故本题选B。
本题难度:简单
2、选择题 下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②含有金属阳离子的晶体一定是离子晶体 ③共价键可决定分子晶体的熔、沸点 ④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小 ⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列 ⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定⑦干冰晶体中(晶胞中的8个顶点和六个面心均有一个分子),一个CO2分子周围有12个CO2分子紧邻;所有的分子晶体都属于密堆积
A.①②③
B.②③④
C.④⑤⑥
D.②③⑦
参考答案:D
本题解析:含有金属阳离子的晶体不一定是离子晶体,例如金属晶体中也含有阳离子,②不正确;决定分子晶体的熔、沸点的是分子间作用力,③不正确;所有的分子晶体不一定都属于密堆积,例如冰,⑦不正确,其余选项都是正确的,答案选D。
点评:晶体熔沸点高低比较的一般规律是:原子晶体,熔沸点大小和共价键的强弱有关系;金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高;分子晶体中形成分子晶体的分子间作用力越大,熔沸点越高;离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。
本题难度:一般
3、选择题 晶体具有各向异性,如蓝晶石(Al2O3 SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率是与层平行的方向上的导电率的1/104。晶体的各向异性主要表现在
SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率是与层平行的方向上的导电率的1/104。晶体的各向异性主要表现在
[? ]
①硬度?②导热性?③导电性?④光学性质 ?
A.①③?
B.②④ ?
C.①②③?
D.①②③④
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列分子或离子中,不含有孤电子对的是
[? ]
A. H2O
B. H3O+
C. NH3
D. CH4
参考答案:D
本题解析:
本题难度:简单
5、填空题 .①MgCl2?②干冰③冰?④NaCl?⑤白磷(P4)⑥SiO2?⑦Na2CO3?⑧金刚石?⑨NaOH (填序号)(每空2分)
(1)属于离子晶体的是?(2)属于分子晶体的是?
(3)属于原子晶体的是_______?(4)熔化时只破坏共价键的是______
参考答案:
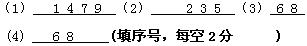
本题解析:略
本题难度:一般