1、填空题 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为____。
(2)卤素互化物如:IBr、ICl等与卤素单质结构相似、性质相似。Cl2、IBr、ICl沸点由高到低的顺序为
________________。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为___________。
(4)气态氟化物中存在二聚分子(HF)2,这是由于_____
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为_____________(填序号)。
2、简答题 如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分.
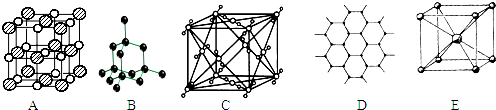
(1)其中代表金刚石的是______(填写编号字母),其中每个碳原子与______个碳原子最接近且距离相等,属于______晶体.
(2)其中代表石墨的是______(填写编号字母),其中每个正六边形占有的碳原子数平均为______个.
(3)其中表示NaCl的是______(填写编号字母),每个钠离子周围与它最接近且距离相等的钠离子有______个.
(4)其中表示CsCl的是______(填写编号字母),它属于______晶体,每个铯离子与______个氯离子紧邻.
3、填空题 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型氢化物分子中既有σ键又有π 键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2 个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于________;Z4+的核外电子排布式为_______________
(2)X的该种氢化物分子构型为____________,X在该氢化物中以____方式杂化。X和Y形成的化合物的熔点应该____(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学反应方程式是____________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的____;
③在M晶体中,Z4+的氧配位数为________;
④已知O2-半径为1.40×10-10m,则Z4+半径为_________m。
4、选择题 下面有关晶体的叙述中,错误的是
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+)
C.白磷晶体中,粒子之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏
5、选择题 下列关于晶体的说法一定正确的是(?)
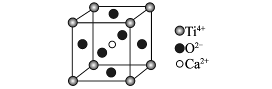
CaTiO3的晶体结构模型(图中Ca2+、O2-、
Ti4+分别位于立方体的体心、面心和顶点)
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+与12个O2-相邻
C.SiO2晶体中每个硅原子与两个氢原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高