|
高中化学知识点讲解《原电池原理》高频试题巩固(2017年最新版)(八)
2017-11-11 04:22:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列有关铜锌原电池(下图)的叙述正确的是
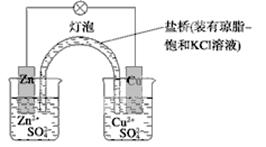
A.正极反应为Zn-2e-===Zn2+
B.取下盐桥,原电池仍可工作
C.在外电路中,电子从正极流向负极
D.电池反应为Zn+Cu2+===Zn2++Cu
|
参考答案:D
本题解析:A、锌比铜活泼,锌是负极失去电子,A错误;B、取下盐桥,不能形成闭合回路,原电池不能再工作,B错误;C、在外电路中,电子从负极流向正极,C错误;D、正极是铜,溶液中的铜离子放电,总反应式为Zn+Cu2+=Zn2++Cu,D错误,答案选D。
考点:考查原电池原理的应用与判断
本题难度:一般
2、填空题 理论上任何自发的氧化还原反应都可以设计成原电池。现使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池。

(1)该电池的负极材料是_______,负极反应式:_________________;
(2)现有如下材料设计类似的水果电池,并使电流计发生明显偏转。酸性水果:柠檬、柑橘、橙子等碱性水果:柿子、葡萄等电极:A.镁条、B.铝片、C.铜片、D.碳棒。
①若选择酸性水果组装水果电池,负极材料可以是:_________(填所有可能的电极选项)正极反应式为:________________
②若选择碱性水果组装水果电池,正极材料可以是:__________(填所有可能的电极选项)假设水果的碱性较强,电池的负极反应式为:__________
(3)原电池的电解质溶液也可以呈中性,例如为海洋中的航行灯提供电能的就是由铝、空气、海水构成的原电池,该电池总反应为4Al+3O2+6H2O=?4Al(OH)3,写出该电池的正极反应式___________________。
参考答案:(1)锌或Zn;Zn-2e-=Zn2+
(2)①:AB;2H++2e-=H2↑;②:ABD;Al-3e-+4OH-=?AlO2-+2H2O
(3)O2+4e-+2H2O=?4OH-
本题解析:
本题难度:一般
3、填空题 (1)写出图①中电解池阴阳两极的电极反应式和该电解池的总反应式:
阴极:______;
阳极:______;
电解池总反应式:______.
(2)写出图②中原电池正负两极的电极反应式和该原电池的总反应式:
正极:______;
负极:______;
原电池总反应式:______.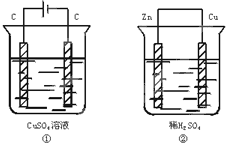
参考答案:(1)惰性电极作电极材料,电解硫酸铜溶液时,阴极上铜离子放电,电极反应式为:Cu2++2e-=Cu,阳极上氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+2H2O,电池反应式为:2CuSO4+2H2O?电解?.?2Cu+O2↑+2H2SO4,
故答案为:Cu2++2e-=Cu;4OH--4e-=O2↑+2H2O;2CuSO4+2H2O?电解?.?2Cu+O2↑+2H2SO4;
(2)铜、锌和稀硫酸构成的原电池中,较活泼的金属锌作负极,铜作正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,负极上锌失电子生成锌离子,电极反应式为Zn-2e-=Zn2+,电池反应式为Zn+2HCl=ZnCl2+H2↑,
故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;Zn+2HCl=ZnCl2+H2↑.
本题解析:
本题难度:一般
4、填空题 (10分)下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(1)当电极a为Al、电极b为Cu、电解质溶液为 稀硫酸时,写出该原电池的总的离子反应反应方程式:?
正极的电极反应式为:?
当a极溶解的质量为5.4g时,有?mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置?(填“能”或“不能”)形成原电池,
若不能,请说明理由?(若能该空不作答),
若能,该原电池的正极为?;该原电池总的化学反应方程式为:??
参考答案:(10分)
(1)2Al + 6H+ ===2Al3+ + 3H2↑? 2H+ + 2e- ="==" H2↑? 0.6(每空2分)
(2) 能(1分)? Mg(1分)? 2Al+ 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑(2分)
本题解析:略
本题难度:简单
5、选择题 关于氢氧燃料电池的说法不正确的是
A.通H2的一极是正极,通O2的一极是负极
B.电池反应式为:2H2 +O2 ="==" 2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率不可能达100%
|