1、简答题 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)?设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为______、______;
②盐桥中K+移向______(填A或B);
③银电极发生的电极反应为______.
(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:______.
(3)100mL?1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/℃?kg-1,则该中和反应的反应热为______.(小数点后面保留一位有效数字)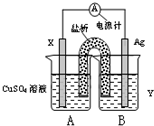
参考答案:(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,活泼的失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;
②原电池反应,B池中Ag+析出,为符合溶液的电中性,盐桥中的钾离子移向B池;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag;
故答案为:Cu、AgNO3溶液;B;Ag++e-=Ag;
(2)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1;
(3)100mL 1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.生成水为0.1mol,测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/°C?kg-1,可以根据计算公式计算得到:Q=-C(T2-T1);稀溶液的密度可以近似为1g/ml,所以Q=-C(T2-T1)=-4.2kJ/°C?kg-1×6.8°C×(200ml×1g/ml×10-3kg/g)=5.71KJ;中和反应生成0.1molH2O,中和反应的反应热是生成1mol水时放出的热量,所以反应的中和热为57.1KJ/mol,
故答案为:57.1 kJ?mol-1.
本题解析:
本题难度:一般
2、填空题 (Ⅰ)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH4(g)+1/2O2?(g)=CO?(g)+2H2(g)△H1=-35.6kJ?molˉ1
试判断常温下,上述反应能否自发进行______(填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2?(g)=CO?2(g)+2H2O(g)△H2=-890.3kJ?molˉ1
③CH4(g)+CO2?(g)=2CO?(g)+2H2(g)△H3=247.3kJ?molˉ1
试结合反应①,确定下面热化学反应方程式中的△H值
CH4(g)+H2O?(g)=CO?(g)+3H2(g)△H=______kJ?molˉ1
(2)恒温下,向一个2L的密闭容器中充入1mol?N2和2.6mol?H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30
c(NH3)/(?mol?Lˉ1)
0.08
0.14
0.18
0.20
0.20
0.20
|
此条件下,该反应达到化学平衡时,氮气的浓度为______.
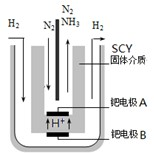
(3)希腊亚里斯多德大学的Marmellos和Stoukides用一种特殊的电解方法合成氨.即在常压下把氢气和用氦气稀释的氮气,分别通入到570℃的电解池中,用高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯多晶薄膜做电极,转化率高达78%.其实验装置如右图.阴极的电极反应式______.
(4)用标准盐酸标定某氨水的浓度时应该选择下列哪种指示剂最好______.
A.甲基橙?B.石蕊?C.酚酞
(Ⅱ)?pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10ˉ3mol?Lˉ1,则pC=-lg(1×10ˉ3)=3.某温度下,H2CO3溶液的pC-pH关系如图.
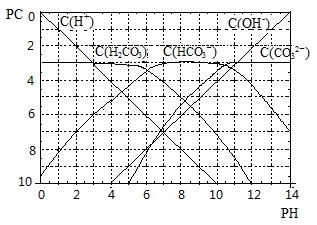
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为______;
(2)求此温度下H2CO3?

H++HCO3ˉ?的电离平衡常数______;
(3)能够抵抗外来少量酸碱的影响、保持自身?pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1mol?Lˉ1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3ˉ

H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液______.
参考答案:(Ⅰ)、(1)反应CH4(g)+1/2O2?(g)=CO?(g)+2H2(g)的△H1=-35.6kJ?molˉ1<0.△S>0根据反应能否自发进行的判据:△H-T△S可推知该数值一定是小于0,故反应能自发进行,能,根据反应①②③,结合盖斯定律,可知反应CH4(g)+H2O?(g)=CO?(g)+3H2(g)△H=①×2-②×12250.3-③×12=250.3kJ?mol-1,故答案为:能;250.3;
(2)根据反应N2 +3H2 ?2NH3
初始浓度:0.5? 1.3? 0
变化浓度:0.1?0.3?0.2
平衡浓度:0.4?1.0?0.2
所以达到平衡时氮气的浓度是1.0mol/L,故答案为:1.0mol/L;
(3)在电解池中,阴极发生得电子的还原反应,在酸性介质下,氮气得电子的过程为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3;
(4)用标准盐酸标定某氨水的浓度时,选择甲基橙能降低滴定误差,故答案为:A;
(Ⅱ)、(1)根据某温度下,H2CO3溶液的pC-pH关系图,可以得出pH=2~4时,H2CO3溶液中主要存在的离子为H+、HCO3-,故答案为:H+、HCO3-;?
(2)此温度下H2CO3?

H++HCO3-的电离平衡常数K=C(H+)?C(HCO3-)C(H2CO3)=10-6?mol/L,故答案为:10-6mol/L;
(3)氨水的电离能产生铵根离子,铵根离子水解能产生一水合氨分子,氨水和氯化铵的混和溶液能够抵抗外来少量酸碱的影响,保持自身pH变化不大,能形成缓冲溶液,故答案为:能.
本题解析:
本题难度:简单
3、选择题 已知在298K时下述反应的有关数据:
C(s)+1/2O2(g)═CO(g)△H1=-110.5kJ?mol-1
C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
则C(s)+CO2(g)═2CO(g)?的△H?为( )
A.+283.5kJ?mol-1
B.+172.5kJ?mol-1
C.-172.5kJ?mol-1
D.-504kJ?mol-1
参考答案:B
本题解析:
本题难度:一般
4、填空题 煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g) =CO2(g);ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g) =H2O(g);ΔH=E3 ③
CO(g)+1/2O2(g) =CO2(g);ΔH=E4 ④
(1)与途径a相比,途径b有较多的优点,即______________________ 。
(2)上述四个热化学方程式中ΔH>0的反应有__________________________ 。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是_____________ 。
A.a比b多 B.a比b少 C.a与b在理论上相同 D.两者无法比较
(4)根据能量守恒定律,E1、E3、E4之间的关系为_________________________。
参考答案:(1)煤的利用率高,变成气体燃料后,运输方便,使燃料充分燃烧。
(2)②
(3)C
(4)E1=E2+E3+E4
本题解析:
本题难度:一般
5、选择题 已知H2(g) +Br2(l)=2HBr(g);△H=-72kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表

则表中a为
[? ]
A.404
B.260
C.230
D.200
参考答案:D
本题解析:
本题难度:一般