1、选择题 控制适合的条件,KI溶液过量,将反应
2Fe3++2I-=2Fe2++I2设计成如下图所示的原电池。下列判断正确的是?

A.反应开始时,甲中石墨电极上Fe3+发生氧化反应
B.反应开始时,乙中石墨电极的反应式:I2+2e-=2I-
C.电流计读数为零时,在甲中加入KSCN溶液,出现血红色
D.电流计读数为零时,反应处在停止状态
参考答案:C
本题解析:
正确答案:C
A、不正确,Fe3+发生还原反应;
B、不正确,乙中石墨电极的反应式:2I--2e-=I2
C、正确;
D、不正确,反应处在平衡状态。
本题难度:一般
2、选择题 下列描述不正确的是(?)
A.纯锌与稀硫酸反应比粗锌的反应速率快
B.用稀硫酸与锌制取氢气时,加入少量硫酸铜溶液,可加快反应的速率
C.纯铁比生铁更难发生电化学腐蚀
D.钢铁腐蚀主要是吸氧腐蚀
参考答案:A
本题解析:粗锌、生铁以及锌与其置换出的铜,加上电解质溶液,可组成原电池,从而使反应速率加快。
本题难度:简单
3、填空题 (12分)某课外活动小组同学用如图装置进行实验,试回答下列问题。
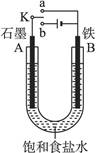
(1)若开始时开关K与a连接,则B极的电极反应式为?。
(2)若开始时开关K与b连接,则其总反应的离子方程式为?。
(3)若用此装置进行电解K2SO4溶液的实验,试回答以下问题:
①开关K应?与连接,
②若标准状况下A极产生2.24 L气体,则溶液中转移?_mol电子
③反应一段时间后,溶液的pH?(填变大、变小或不变),若要电解质溶液复原,
需向溶液中加入的物质为?(填化学式)。
参考答案:(14分)
(1)Fe-2e-====Fe2+?(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)b?0.4mol?③不变? H2O
本题解析:考查原电池、电解池的原理、判断及其应用。
(1)K与a连接则构成原电池,活泼金属作负极,即铁是负极,石墨是正极,因此是铁的吸氧腐蚀,B极的电极反应式为:Fe-2e-====Fe2+。
(2)开关K与b连接,则构成电解池,电解饱和食盐水。石墨和电源正极相连,作阳极,氯离子放电生成氯气。铁和电源负极相连,作阴极,氢离子发生,生成氢气,总反应式为2Cl- + 2H2O  2OH- + H2↑ + Cl2↑。
2OH- + H2↑ + Cl2↑。
(3)①电解池应该有外接电源,所以开关K应与b相连
②电解总方程式为:H2O 2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
③由于原溶液为中性,电解本质是水的减少,所以电解过程中溶液的pH不变,若要电解质溶液复原,只需向溶液中加适量的水即可。
本题难度:一般
4、选择题 对一块铁进行防护,下列方法不正确的是(?)
A.合金
B.涂油
C.漆合金
D.埋在地下
参考答案:D
本题解析:A、合金能改变金属内部结构,对铁进行防护
B、涂油 可以和空气隔绝,能对铁进行防护
C、漆合金,可以隔绝空气,能对铁进行防护
D、埋在地下,地下比较潮湿,并且也有氧气,铁在潮湿的地下也会发生电化学腐蚀,起不到防护的作用。故选D。
本题难度:简单
5、选择题 图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是(?)
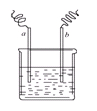
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
参考答案:D
本题解析:可能为电解池,a极发生还原反应,为阴极,b极发生氧化反应,为阳极,电解质可为硫酸铜溶液,故A正确。Cu2+得电子被还原,故B正确。如a、b都为铁片,电解质溶液为硫酸铜,电解可发生题中反应,故C正确。可为电解池,电能转化为化学能,故D错误。
本题难度:一般