| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》试题巩固(2017年最新版)(四)
参考答案:B 本题解析:氯化铵溶于水发生水解,溶液显酸性,为了配制NH4+ 浓度与Cl-的浓度比为1:1的溶液,则应该抑制NH4+ 的水解,①适量的HCl可以抑制NH4+ 的水解,但又增加了氯离子的浓度,错误;②适量的NaCl,对水解没有影响,但增加了Cl-的浓度,错误;③氨水电离出NH4+ ,正确;④适量的NaOH,促进了NH4+ 的水解,错误;选B。 本题难度:一般 2、选择题 对于1L 0.1 mol·L-1 NH4Cl溶液,正确的是 |
参考答案:B
本题解析:A.NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应消耗水电离产生的OH-,促进了水的电离,最终当溶液达到平衡时,c(H+)>c(OH-),所以溶液显酸性。错误;B.通入少量HCl,盐的水解平衡逆向移动,c(NH4+)增大;由于加入了盐酸,所以c(Cl-)也增大,正确;C.由于铵根离子发生水解反应产生NH3?H2O,根据物料守恒可知溶液中含有NH4+数目小于0.1NA,错误;D.盐的水解反应是吸热反应,升高温度,会促进盐的水解,溶液的酸性增强,所以溶液pH降低,错误。
考点:考查盐的水解及物料守恒、水解平衡的影响因素的知识。
本题难度:一般
3、选择题 在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A.NaOH
B.H2SO4
C.KCl
D.CH3COOH
参考答案:B
本题解析:硫酸铁水解生成氢氧化铁和硫酸,为抑制水解,加少量硫酸。
考点:盐类水解的应用
点评:配制氯化铁溶液时,为防止水解,可将氯化铁溶液溶于盐酸,再加水稀释到所需浓度。
本题难度:一般
4、选择题 下列化合物在一定条件下既能发生消去反应,又能发生水解反应的是( ? )
A.CH3Cl
B.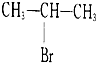
C.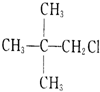
D.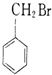
参考答案:B
本题解析:
本题难度:简单
5、选择题 在10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C.C(Na+)= C(CH3COO-)+C(CH3COOH)
D.C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
参考答案:A
本题解析:10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,酸碱恰好反应生成CH3COONa ,CH3COONa属于强碱弱酸盐,CH3COO-会水解导致溶液显碱性,CH3COO-浓度减小,所以反应后溶液中各粒子的浓度关系为C(Na+)>C(CH3COO-)>C(OH-)>C(H+),A项错误;B项正确;C项符合物料守恒,正确;D项符合电荷守恒,正确;选A。
考点:考查溶液中离子浓度的大小比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《能量的相互.. | |