1、简答题 (13分)工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。
I.高温煅烧还原法
工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下:
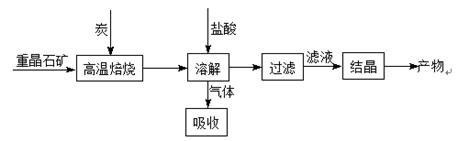
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s)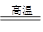 4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)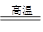 2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为: 。
(2)反应C(s) + CO2(g)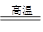 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是 。
II.沉淀转化法
(4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为 ; 反应的平衡常数K= ;Na2CO3溶液的最初浓度不得低于 。
2、选择题 下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是
A.该溶液中,Na+、H+、Cl-、NO3-可以大量共存
B.和新制氯水反应的离子方程式:Fe2++Cl2=Fe3++2Cl-
C.加入NaOH溶液至Fe2+刚好沉淀完全的离子方程式: Fe2++2OH-=Fe(OH)2↓
D.离子浓度关系:c(SO42-) = c(NH4+ )>c(Fe2+ )>c(H+ )>c(OH-)