1、选择题 下列鉴别方法可行的是
A.用NH3·H2O溶液鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl—、SO2—4和CO2—3
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用新制氢氧化铜悬浊液鉴别甲醛和甲酸甲酯
参考答案:C
本题解析:A13+、Mg2+与NH3·H2O反应,二者均生成白色沉淀,因此无法鉴别;SO42-和CO32-均可与Ba(NO3)2生成白色沉淀,无法鉴别;甲醛和甲酸甲酯均可与新制氢氧化铜悬浊液在加热条件下反应得到红色沉淀,因此无法鉴别;1一溴丙烷的核磁共振氢谱有3个峰、2—溴丙烷的核磁共振氢谱有2个峰,C项正确。
本题难度:一般
2、选择题 下列各组物质中,W为主体物质,X为杂质,Y是除去杂质所加试剂,Z是除去杂质所用方法,其中正确选用了试剂和处理方法的是( )
| W | X | Y | Z
A
CH3COOC2H5
CH3COOH
饱和Na2CO3溶液
分液
B
CO2
HCl
饱和Na2CO3溶液
洗气
C
NaCl固体
I2
CCl4
分液
D
Na2CO3
NaHCO3溶液
Ca(OH)2溶液
过滤
|
A.A
B.B
C.C
D.D
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列图示的四种实验操作名称从左到右依次是
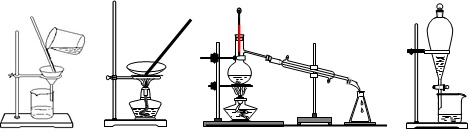
A.过滤、蒸发、蒸馏、分液
B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液
D.分液、蒸馏、蒸发、过滤
参考答案:A
本题解析:从左到右依次为过滤、蒸发、蒸馏、分液,选A。
本题难度:一般
4、填空题 (13分)一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
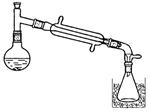
某学生的实验过程和具体操作可简述如下:
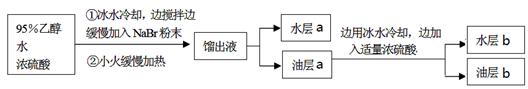
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是?。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有?,检验该离子的方法是??。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
实验步骤
| 预期现象和结论
|
步骤1:将油层b转移至?中,再加入足量稀 Na2SO3溶液充分振荡,静置。
| ?
|
步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。
| 溶液分层,下层呈橙红色,证明?。
|
步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中,?至温度计升高至450C左右。
| 馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。
|
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率?(用小数表示,保留二位小数)。
参考答案:(13分)
(1)防止产品挥发损失(1分)
(2)SO42-(1分),取少量水层a的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液,若产生浑浊,有SO42-,否则无SO42-。(2分)
(3)
实验步骤
预期现象和结论
?分液漏斗?(1分)
液体分层,下层液体逐渐褪为无色。(2分)?
?
油层b中含有Br2(2分)?
水浴加热 (2分)
?
(4)0.67?(2分)
本题解析:(1)一溴乙烷的沸点较低,易挥发,所以锥形瓶置于冰水混合物中的目的是防止产品挥发损失;
(2)制备一溴乙烷所用试剂有浓硫酸,所以水层a中的离子除Na+、H+、OH-和Br-外,一定还有SO42-;SO42-的检验方法是取少量水层a的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液,若产生浑浊,有SO42-,否则无SO42-。
(3)步骤2中溶液出现分层现象,所以将油层b转移至分液漏斗中,便于分离溶液;一溴乙烷中可能含有CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2等杂质,而使溶液显黄色。一溴乙烷的密度比水大,Na2SO3溶液可以吸收Br2、SO2在溶液的上层,一溴乙烷等油层在溶液的下层,所以出现的现象是液体分层,下层液体逐渐褪为无色;步骤2中用新制氯气和四氯化碳溶液萃取,溶液分层,下层呈橙红色,证明原油层中b中含有Br2;步骤1的油层中含有一溴乙烷、CH2BrCH2Br等,一溴乙烷的沸点较低,所以控制温度在38℃左右时溜出的馏分是一溴乙烷,常用水浴加热的方法,控制温度。
(4)乙醇的物质的量大于溴化钠的物质的量,所以理论上生成0.15mol的一溴乙烷,实际得到10.9g/0.1mol的一溴乙烷,所以产率=0.1mol/0.15mol=0.67.
本题难度:简单
5、选择题 现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是
物质
| 分子式
| 熔点℃
| 沸点℃
| 密度(g/cm3)
| 溶解性
|
乙二醇
| C2H6O2
| -11.5
| 198
| 1.11
| 易溶于水和酒精
|
丙三醇
| C3H8O3
| 17.9
| 290
| 1.26
| 能跟水、酒精以任意比互溶
|
A.萃取法? B.结晶法? C.分液法? D.蒸馏法
参考答案:D
本题解析:略
本题难度:一般