1、填空题 (16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2  2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
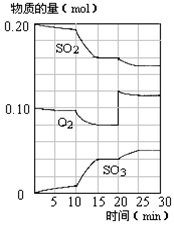
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
参考答案:(1)SO2(g)+ 1/2O2(g) = SO3(g) △H = -85kJ/mol (3分)
(2)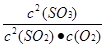 (2分) (3)减小 ,增大。(4分)
(2分) (3)减小 ,增大。(4分)
(4)b.d.(2分) (5)d(2分) (6)20%(3分)
本题解析:(1)在450℃条件下,SO3为气态,再根据64g SO2完全转化为SO3会放出85kJ热量,可知该反应的热化学方程式为:SO2(g)+1/2O2(g)=SO3(g)△H=-85kJ/mol;
(2)2SO2(g)+O2(g) 2SO3(g),依据化学平衡常数概念是平衡状态生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积得到,平衡常数为:K=
2SO3(g),依据化学平衡常数概念是平衡状态生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积得到,平衡常数为:K=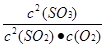 ;
;
(3)降低温度反应速率减小,该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数k增大;
(4)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,a和c错误,b和d 正确,故答案为:bd;
(5)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变,a、10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故a错误;b、增大容器体积,减小压强,反应速率降低,故b不正确;c、降低温度反应速率降低,故c错误;d、加了催化剂,增大反应速率,故d正确;故答案为:d;
(6)由图可知,起始时SO2的物质的量为0.2mol,平衡时SO2的物质的量为0.16mol,则SO2的转化率=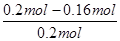 ×100%=20%。
×100%=20%。
考点:考查热化学方程式、平衡常数、平衡移动的影响因素、化学平衡图象、转化率等
本题难度:一般
2、选择题 室温下浓度为0.1 mol / L的三种一元碱溶液:AOH、BOH、COH,其中AOH中的c(OH—)=0.01 mol / L,BOH的电离度为1%,COH的c(H+)=1×10-13mol / L,则室温下三种碱所形成的氯化物:ACl、BCl、CCl的溶液在物质的量浓度相同的情况下,其pH由大到小的顺序是?
A.ACl>BCl>CCl
B.CCl>ACl>BCl
C.CCl>BCl>ACl
D.BCl>ACl>CCl
参考答案:B
本题解析:AOH中的c(OH—)=0.01 mol / L,则AOH的电离度是10%。COH的c(H+)=1×10-13mol / L,则根据水的离子积常数可知,c(OH—)=0.1 mol / L,所以COH是强碱。即碱性强弱顺序是COH、AOH、BOH。碱越弱,相应的盐越容易水解,溶液酸性越强,所以选项B正确。
本题难度:简单
3、选择题 充分说明反应P(g)+Q(g)?R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
参考答案:A、该反应为体积不变的反应,反应过程中气体的总物质的量始终不变,所以压强始终不变,压强不能作为判断平衡状态的标志,故A错误;
B、任何的可逆反应中,反应物和生成物都同时存在,无法判断是否达到平衡状态,故B错误;
C、P的生成速率和S的生成速率相等,为正逆反应速率相等,达到了平衡状态,故C正确;
D、该反应方程式两边气体的物质的量不变,所以反应容器内气体的总物质的量始终不变,气体的总物质的量不能作为判断达到平衡状态的标准,故D错误;
故选C.
本题解析:
本题难度:一般
4、简答题 已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
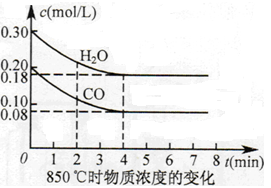
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)= 。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
参考答案:(1)K=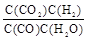 <
<
(2)0.03 mol/(L·min)
(3)75%
(4)y=x
(5)CO2+2e-+H2O=CO+2OH-
(6)不可能;ΔH>0吸热且ΔS<0 或依据吉布斯自由能判断反应不能自发进行
本题解析:(1)根据平衡常数的定义可得K=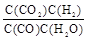 ,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
(2)0—4min时,CO的浓度减少0.12mol/L,所以v(CO)="0.03" mol/(L·min) 。
(3)500 ℃时,K=9,设CO的浓度减少xmol/L,则有9(0.02-x)2=x2,x=0.015mol/L,该条件下,CO最大的转化率为75%。
(4))850 ℃时,K=1,起始时CO和H2O共为1mol,其中水蒸气的体积分数是x,所以H2O(g)的物质的是为xmol,CO的物质的量为(1-x)mol,设平衡时CO转化了amol,则a2=(x-a)(1-x-a),解得a=x-x2,CO的转化率为(x-x2)/(1-x)=x;
(5)总的是2CO2=2CO+O2,阳极反应为4OH—4e-=2H2O+O2,则总反应减去阳极得到阴极反应式为,CO2+2e-+H2O=CO+2OH- 。
(6)不可能,因为该反应属于熵减焓增的反应,不能自发进行。
本题难度:一般
5、选择题 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)  2C(g)+D(g) 已达平衡状态的是( )
2C(g)+D(g) 已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.B的生成速率与D的消耗速率之比为3:1
D.气体的总物质的量