1、计算题 t ℃时,将3 mol A和2 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g)x C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
(1)x=_________。
(2)用A表示该反应的速率为_________mol·L-1·min-1。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________(填写下列选项字母序号)。
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t ℃时,若向平衡混合物的容器中再充入a mol C,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B_________mol(用含a的式子表示);达新平衡时,A的物质的量为n(A)=_________(用含a的式子表示)。
2、填空题 将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB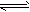 cC(固)+dD。当反应进行一定时间后,测得A减少n mol,B减少了,C增加了,D增加了n mol,此时达到化学平衡。?
cC(固)+dD。当反应进行一定时间后,测得A减少n mol,B减少了,C增加了,D增加了n mol,此时达到化学平衡。?
(1)该化学方程式中各物质的系数为:a=_______,b=_______,c=_______,d=_______;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A_______、B_______、C_______;
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为_______反应(填吸热或放热)。
3、选择题 已知:C(s)+CO2(g)  2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度
B.增加碳的质量
C.增大压强
D.加入催化剂