1、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是:

[? ]
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:
本题难度:一般
2、选择题 一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)?2B(g)+C(g),下列能说明反应已达平衡状态的是( )
A.混合气体的密度保持不变
B.容器内B、C的浓度之比为2:1
C.B的生成速率等于C的消耗速率
D.气体的体积分数保持不变
参考答案:A、根据ρ=mV,容器容积不变,反应物A是固体,只要反应没有达到平衡状态,气体的质量就会不变,当达到了平衡状态后,气体的密度不变,故A正确;
B、无论是否达到平衡状态,B、C的浓度之比始终是2:1,故容器内B、C的浓度之比为2:1无法判断是否达到了平衡状态,故B错误;
C、由于B和C的化学计量数不相等,达到平衡状态时,B的生成速率等于2倍的C的消耗速率,故C错误;
D、体系中气体只有B、C,无论是否达到了平衡状态,体积比始终是2:1,体积分数始终不变,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 哈珀因分明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一个容积为2L的恒容的密闭容器中,加入N2、H2各4mol,在一定条件下使合成氨气反应发生,反应在10s时达到了反应的限度,这是H2的平均反应速率为0.12mol/(L?s),下列一个说法正确的是( )
A.容器中混合气体的密度增大
B.此时容器中气体的压强是反应前气体压强的0.8倍
C.达到反应限度时H2的转化率是20%
D.此时容器中N2的物质的量为1.6mol
参考答案:A、N2(g)+3H2(g)

2NH3(g),反应前后都是气体,根据质量守恒,可知反应前气体的总质量和达到反应的限度时气体的总质量相等,容器的体积不变,所以密度不变,故A错误;
B、H2的平均反应速率为0.12mol/(L?s),则反应的H2的物质的量浓度为0.12mol/(L?s)×10s=1.2mol/L,反应的H2的物质的量为1.2mol/L×2L=2.4mol,根据化学平衡三段法可知:
? N2(g)+3H2(g)

2NH3(g)
起始(mol)? 4? 4? 0
反应(mol)? 0.8? 2.4? 1.6
10s(mol)? 3.2? 1.6? 1.6
反应前气体总的物质的量为:8mol,10s时气体总的物质的量为6.4mol,所以10s容器中气体的压强是反应前气体压强的0.8倍,故B正确;
C、由选项B可知反应的氢气为2.4?mol,则氢气的转化率为:2.4?4?×100%=60%,故C错误;
D、由选项B可知容器中N2的物质的量为3.2mol,故D错误;
故选B.
本题解析:
本题难度:简单
4、填空题 汽车内燃机工作时产生的高温会引起N2和O2 发生反应生成NO气体,其方程式为: N2 (g) +O2(g) 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
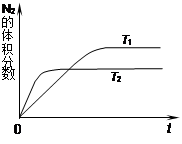
(1)右图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g) N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g)
N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g) 2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。
2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时反应N2 (g)+O2(g) 2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=
参考答案:
本题解析:
本题难度:困难
5、填空题 (18分)有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
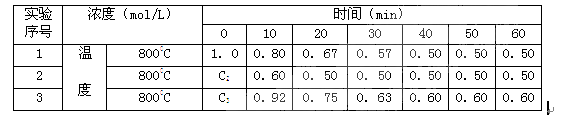
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常 数= ,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
参考答案:(18分,每空2分)(1)0.0165
(2)1.0,使用了催化剂;
(3)>,0.25,1.2,增加反应物A的浓度;
(4)0.5, 50%
本题解析:(1)在实验1,反应在0至20分钟时间内A的浓度减少1.0-0.67=0.33mol/L,所以A的平均反应速率为0.33mol/L/20min="0.0165" mol/(L·min);
(2)该反应是反应前后物质的量不变的可逆反应,温度不变时实验2与实验1达到平衡状态时A的浓度相同,且达到平衡的时间缩短,所以实验2与实验1是等效平衡,实验2使用了催化剂,A的起始浓度与实验1相同,所以C2=1.0mol/L;
(3)由表中数据,实验3平衡时A的浓度为0.6mol/L,实验3与实验1的温度相同,达到的平衡仍是等效平衡,所以平衡时A的浓度扩大几倍,起始浓度就扩大几倍,所以A的起始浓度C3=1.0mol/L×0.60/0.50=1.20mol/L,反应物浓度增大,所以反应速率增大,v3>v1;根据实验1可计算平衡常数K,实验1 中B、D的平衡浓度都是0.25mol/L,所以K=0.252/0.502=0.25;
(4)B+D  2A的平衡常数K1=1/0.25=4,设平衡时B、D的浓度是xmol/L,则A的平衡浓度是2(0.5-x)=1-2x,所以(1-2x)2/x2=4,解得x=0.25,所以A的平衡浓度是1-0.5=0.5mol/L,平衡时B的转化率是(0.5-0.25)mol/L/0.5mol/L×100%=50%。
2A的平衡常数K1=1/0.25=4,设平衡时B、D的浓度是xmol/L,则A的平衡浓度是2(0.5-x)=1-2x,所以(1-2x)2/x2=4,解得x=0.25,所以A的平衡浓度是1-0.5=0.5mol/L,平衡时B的转化率是(0.5-0.25)mol/L/0.5mol/L×100%=50%。
考点:考查等效平衡的判断,化学平衡的计算
本题难度:一般