1、选择题 在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:
A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n molB
参考答案:B
本题解析:由反应方程式可以看出,反应前后气体体积不变,但气体的质量发生了改变。因此,当达到化学平衡时,气体的质量应保持不变,混合气体的密度也应保持不变。故答案选B。
点评:化学平衡移动的考查,是历年高考的重点,应特别注意有气体参与的反应。若反应前后气体体积发生变化,则可根据压强、混合气体的密度判断化学平衡。
本题难度:一般
2、选择题 将2.0mol?SO2气体和2.0mol?SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n?mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n?mol的是( )
A.1.6?mol?SO2+0.3?mol?O2+0.4?mol?SO3
B.4.0?mol?SO2+1.0?mol?O2
C.2.0?mol?SO2+1.0?mol?O2+2.0?mol?SO3
D.3.0?mol?SO2+0.5?mol?O2+1.0?mol?SO3
参考答案:开始投入2.0mol?SO2气体和2.0mol?SO3气体,等效为开始投入4.0mol?SO2气体和1mol?O2气体,在恒温恒容下,平衡时SO3的物质的量不变为n?mol,说明应是完全等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol?SO2气体和1mol?O2气体.
A、开始为1.6?mol?SO2+0.3?mol?O2+0.4?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=1.6mol+0.4?mol=2mol,n(O2)=0.3mol+12×0.4mol=0.5mol,不满足4.0mol?SO2气体和1mol?O2气体,故A错误;
B、开始为4.0?mol?SO2+1.0?mol?O2,与原平衡等效,故B正确;
C、开始为2.0?mol?SO2+1.0?mol?O2+2.0?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=2mol+2?mol=4mol,n(O2)=1mol+12×2mol=2mol,不满足4.0molSO2气体和1molO2气体,故C错误;
D、开始为3.0?mol?SO2+0.5?mol?O2+1.0?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=3mol+1?mol=4mol,n(O2)=0.5mol+12×1mol=1mol,满足4.0molSO2气体和1molO2气体,故D正确.
故选BD.
本题解析:
本题难度:简单
3、选择题 有一化学平衡mA(g)+nB(g)  PC(g)+qD(g),右图表示A的转化率与压强、温度的关系。由此得出的正确结论是
PC(g)+qD(g),右图表示A的转化率与压强、温度的关系。由此得出的正确结论是

A.正反应是吸热反应
B.(m+n)<(p+q)
C.压强增大,A的转化率减小
D.温度升高,A的转化率减小
参考答案:A
本题解析:根据图像可知,随着温度的升高,A的转化率升高,说明升高温度平衡向正反应方向移动,即正方应是吸热反应,A正确,D不正确;当温度不变时,增大压强A的转化率升高,说明增大平衡向正反应方向移动,即正方应是体积减小的,所以(m+n)>(p+q),BC不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对基础性知识的巩固与训练,有助于调动学生的学习积极性,培养学生的应试能力。该题的关键是理解外界条件是如何影响平衡状态的,然后结合反应和图像灵活运用即可。
本题难度:一般
4、选择题 把6 mol A和5 mol B的混合气体通入容积为4 L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g) 6C(g)+xD(g),经5 min后反应达到平衡,此时生成C 3 mol,并测得D的平均反应速率为0.1 mol·L-1·min-1。下列说法正确的是(? )
6C(g)+xD(g),经5 min后反应达到平衡,此时生成C 3 mol,并测得D的平均反应速率为0.1 mol·L-1·min-1。下列说法正确的是(? )
A.x=2
B.A的转化率是41.67%
C.B的平衡浓度为0.75 mol·L-1
D.反应前后混合气体的压强比为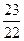
参考答案:BC
本题解析:5A(g)+4B(g) 6Cl(g)+xD(g)
6Cl(g)+xD(g)
n(A)? n(B)? 3 mol? n(D)
n(A)="2.5" mol? n(B)="2" mol? n(D)=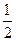 x mol
x mol
v(D)=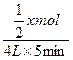 ="0.1" mol·L·min,x=4(A错)
="0.1" mol·L·min,x=4(A错)
A%=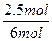 ×100%=41.67%,c(B)=
×100%=41.67%,c(B)=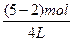 ="0.75" mol·L
="0.75" mol·L
反应前n="11" mol,反应后n="(6-2.5)" mol+(5-2) mol+3 mol+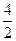 ?mol="11.5" mol
?mol="11.5" mol
反应前的混合气体的压强比为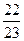 。
。
本题难度:简单
5、填空题 某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H2
2NH3达平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是:
①若x=0,y=0,则z=?;
②若x="0.75" mol,则y=?,z=?;
③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一
个含y、z)?。
若将上述条件 改为恒温、恒压,其它均不变,则
a.若x=0,y=0,则z=?;
b.若x="0.75" mol,则y=?,z=?;
c.x、y、z取值必须满足的一般条件是?。
参考答案:①2mol②y=2.25mol,z=0.5mol
③z=2-2x,z=2-2/3y;a、z>0;b、y=2.25mol,z≥0;c、y=3x,z≥0.
本题解析:①恒温恒容条件下,改变初始物质的加入量,达到平衡时各物质的浓度不变,意味着新平衡与原平衡是等效平衡。对于反应前后气体的物质的量变化的可逆反应而言,两次加入的物质的物质的量完全相同即可达到等效平衡,所以开始充入1mol N2和3 mol H2,相当于充入2mol NH3,则x=0,y=0时,z=2mol;
②同理x=0.75mol,氢气的物质的量是氮气的3倍,则y=2.25mol,此时相当于充入1.5mol的NH3,所以只需再充入0.5mol NH3,即可达到与原平衡等效,即z=0.5mol
③根据①②的数据可得,x、y、z满足的条件是z=2-2x,z=2-2/3y;
若改为恒温恒压条件,则只需加入的物质的物质的量对应成比例即可达到等效平衡。a、若x=0,y=0,则z为任意不为0的数值;b、若x="0.75" mol,开始时氢气的物质的量是氮气的3倍,氨气无论是多少,转化为氮气、氢气时,二者的物质的量之比都是1:3,所以y=2.25mol,z≥0;c、由以上分析可知恒温恒压下,达到与原平衡等效时x、y、z取值必须满足的一般条件是y=3x,z≥0.
本题难度:一般