|
高考化学知识点整理《反应速率与平衡的有关计算》高频试题巩固(2017年最新版)(六)
2018-03-17 05:28:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 在一定条件下,将A2和B2气体通入1 L密闭容器中,反应按下式进行:mA2+nB2 2C,2 s内反应速率如下:v(A2)=0.5 mol/(L·s),v(B2)=1.5 mol/(L·s),v(C)=1mol/(L·s),则m和n 的值分别为 2C,2 s内反应速率如下:v(A2)=0.5 mol/(L·s),v(B2)=1.5 mol/(L·s),v(C)=1mol/(L·s),则m和n 的值分别为
[? ]
A.2、3
B.3、2
C.3、1
D.1、3
参考答案:D
本题解析:
本题难度:简单
2、选择题 在一恒容密封容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题: 2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题:
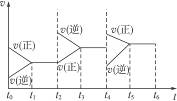
(1)处于平衡状态的时间段有____________。
(2)起始时投入的物质成分为____________。
A.SO2,O2
B.SO2,SO3
C.SO3
D.SO2,O2,SO3
| (3)t2—t3、t4—t5时间段平衡的移动方向分别为____________、____________。(填“正反应方向”或“逆反应方向”)
参考答案:(1)t1—t2,t3—t4,t5—t6? (2)D? (3)逆反应方向?正反应方向
本题解析:(1)从v的角度看,平衡时v(正)=v(逆)(平衡状态的直接标志之一)。故达平衡的时间段有:t1—t2,t3—t4,t5—t6。
(2)因t0时v(正)、v(逆)均大于0(这个细节不要忽视!),故反应物和生成物均有。答案为D。
(3)平衡被破坏时,主要发生何种反应,平衡即向该反应方向移动(移动方向的判断标准)。因t2、t4两时刻分别为:v(逆)>v(正)、v(正)>v(逆),故移动方向分别为逆反应方向和正反应方向。
本题难度:简单
3、填空题 (每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则: 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=?
②.若a=0.7,b=2.1,则:
Ⅰ.c=??.
Ⅱ.这时反应向?进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是?
参考答案:4? 2.6?逆反应方向? 1<c≤4
本题解析:略
本题难度:简单
4、选择题 已知200 ℃,反应2NO(g)+2CO(g) 2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( ) 2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
?
| c(NO)
| c(CO)
| c(CO2)
| c(N2)
| A
| 1
| 1
| 0.1
| 0.1
| B
| 0.1
| 0.1
| 0.1
| 0.1
| C
| 0.2
| 0.1
| 0.2
| 1
| D
| 0.3
| 0.2
| 0.2
| 0.3
|
?
参考答案:B
本题解析:根据方程式写出浓度商的表达式,然后代入数值计算,浓度商与平衡常数相等时即为平衡状态。B项中Q=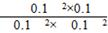 =10,即Q=K,处于平衡状态。 =10,即Q=K,处于平衡状态。
本题难度:一般
5、选择题 某恒温密闭容器中,可逆反应A(s)  ?B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 ?B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
D. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
参考答案:BD
本题解析:A、若B为气体,且原平衡时B与C的浓度相等时,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变,错误;B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,正确;C、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,错误;D、保持体积不变,B可以是气体或是非气体,若B为气体,则向平衡体系中加入B,平衡向逆反应方向移动,正确。
本题难度:一般
|