|
高考化学知识点整理《原电池原理》在线测试(2017年最新版)(十)
2018-03-17 05:29:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是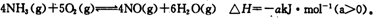
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为?。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是?。
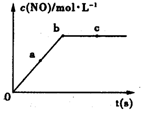
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
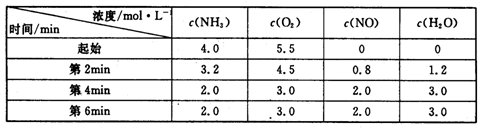
①第2min到第4mim,反应速率v(O2)=?;
②第2min时改变了条件,改变的条件可能是?(从所给选项中选择);
A.降低温度
B.增加了生成物
C.减小压强
D.使用了高效催化剂
| ③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应?(填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为?。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:


则1mol甲烷直接将NO2还原为N2的烩变为____?。
参考答案:(14分,每空2分)(1)80%? (2)υ(a正)>υ(b逆)=υ(c正)
(3)①0.75mol/(L·min)(不带单位给1分)?②D?③正反应方向进行
(4)CO(NH2)2+NO+NO2 CO2+2N2+2H2O CO2+2N2+2H2O
(5)△H=-867kJ/mol(或-867kJ·mol-1)(无负号不给分)
本题解析:(1)根据热化学方程式可知,若达到平衡时放出热量0.8akJ,则消耗氨气的物质的量是 =3.2mol,所以氨气的转化率是 =3.2mol,所以氨气的转化率是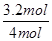 ×100%=80%。 ×100%=80%。
(2)根据图像可知,a点煤油达到平衡状态,b和c点NO的浓度不再发生变化,属于平衡状态,因此NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是υ(a正)>υ(b逆)=υ(c正)。
(3)①根据表中数据可知,第2min到第4mim内氧气的浓度减少了4.5mol/L-3.0mol=1.5mol/L,所以反应速率v(O2)=1.5mol/L÷2min=0.75mol/(L·min)。
②根据表中数据可知,前2分钟内氧气的浓度减少5.5mol/L-4.5mol=1.0mol/L,即第2min时反应速率明显高于前2分钟的反应速率,所以改变的条件可能是使用了高效催化剂,答案选D。
③根据表中数据可知,平衡时NH3、O2、NO和H2O(g)的浓度(2moI/L)分别是2.0、3.0、2.0、3.0,所以该温度下反应的平衡常数K=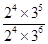 = =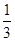 。如果起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则此时Q= 。如果起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则此时Q= =0.5> =0.5>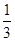 ,所以该反应正反应方向进行。 ,所以该反应正反应方向进行。
(4)根据原子守恒可知,反应中除了生成氮气以外,还有CO2和水产生,则该反应的化学方程式是CO(NH2)2+NO+NO2 CO2+2N2+2H2O。 CO2+2N2+2H2O。
(5)根据盖斯定律可知,两式相加即得到2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g),所以该反应的反应热△H=-574kJ/mol-1160kJ/mol=-1734kJ/mol,则1mol甲烷直接将NO2还原为N2的烩变为△H=-1734kJ/mol÷2=-867kJ/mol。
本题难度:困难
2、选择题 下图各装置中,不能构成原电池的是 ( ) 
参考答案:D
本题解析:构成原电池的条件是活泼性不同的金属或金属与非金属,导线相连后插入到电解质溶液中,据此可知选项ABC都能构成原电池。D中没有构成完整的闭合回路,不能形成原电池,答案选D。
考点:考查原电池的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。只要是考查学生对原电池形成条件的熟悉掌握程度,以及灵活运用知识逻辑推理能力,也有助于提高学生的应试能力和学习效率。
本题难度:简单
3、填空题 (1)Zn
参考答案:
本题解析:
本题难度:一般
4、填空题 (共8分)燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)已知燃料电池的总反应式为CH4 + 2O2 + 2KOH ="=" K2CO3 + 3H2O,电池中有一极的电极反应为CH4 + 10 OH- - 8e- == CO2-3 + 7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(2)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(3)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
参考答案:(1)负极; 2O2+4H2O+8e-==8OH- (2)减小 (3)大于
本题解析:(1)原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。所以甲烷在负极通入,氧气在正极通入。由于溶液中电解质是氢氧化钾,所以正极反应式是
2O2+4H2O+8e-==8OH-。
(2)根据总的反应式可知,在反应过程中是消耗氢氧化钾的,所以溶液的碱性是降低的。
(3)燃料电池的硫利用率要大于甲烷直接燃烧的能量利用率。
本题难度:一般
5、选择题 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
[? ]
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
参考答案:C
本题解析:
本题难度:一般
| 
