1、选择题 如图所示装置中,当闭合K时,下表中装置的描述正确的一项是
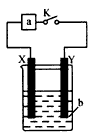
[? ]
a?
X极材料
Y极材料
? b
对装置的描述
A.
电流表?
石墨
铜
氯化铁溶液
铜为负极,石墨电极质量增加
B.
电流表?
铁
铜
盐酸
电子流动路径是:铁→外电路→铜→
盐酸→铁,从而构成闭合回路
C.
直流电源?
石墨
石墨
硫酸
?溶液的pH始终保持不变
D.
直流电源
?铜
铁
硫酸铜溶液
溶液中Cu2+的浓度可能保 持不变
参考答案:D
本题解析:
本题难度:一般
2、选择题 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
参考答案:C
本题解析:当杠杆为导体时,构成了原电池,A端Cu球上会析出铜增重,A端低;当杠杆为绝缘体时,加CuSO4溶液后溶液密度增大,对Cu球的浮力增大,所以A端上升。
本题难度:一般
3、选择题 有关下图的说法正确的是
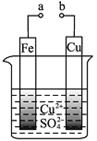
A.构成原电池时Cu极反应为: Cu
参考答案:
本题解析:
本题难度:一般
4、填空题 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城市煤气等,市场前景极为广阔。它清洁、高效,具有优良的环保性能。
工业上制二甲醚是在一定温度(230~280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应。
CO(g)+2H2(g)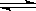 CH3OH(g)? ΔH1=-90.7 kJ·mol-1 ①
CH3OH(g)? ΔH1=-90.7 kJ·mol-1 ①
2CH3OH(g)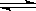 CH3OCH3(g)+H2O(g)? ΔH2=-23.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g)? ΔH2=-23.5 kJ·mol-1 ②
CO(g)+H2O(g)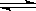 CO2(g)+H2(g)?ΔH3=-41.2 kJ·mol-1 ③
CO2(g)+H2(g)?ΔH3=-41.2 kJ·mol-1 ③
(1)反应器中的总反应可表示为3CO(g)+3H2(g)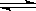 CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
(2)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g) ΔH>0。
该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是________。
A.容器内混合气体的密度不变
B.容器内混合气体的压强保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2的同时消耗1 mol二甲醚
(3)二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚与乙醇互为同系物
D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(4)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),写出A电极的电极反应式:________________________________________。

参考答案:(1)-246.1 kJ·mol-1 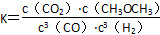 升高 (2)A (3)A (4)B电极 CH3OCH3+3H2O-12e-=2CO2+12H+
升高 (2)A (3)A (4)B电极 CH3OCH3+3H2O-12e-=2CO2+12H+
本题解析:(1)根据盖斯定律,ΔH=2ΔH1+ΔH2+ΔH3=-246.1 kJ·mol-1,增大压强,平衡向正反应方向移动,二甲醚的产率升高。(2)该反应特点是,所有反应物和产物都是气态,正反应是气体分子数减小的反应,正反应吸热。恒容条件下,密度始终不变,A选项错误;正反应是气体分子数减小的反应,压强不改变时表明反应达到平衡状态,B选项正确;气体摩尔质量等于质量与物质的量之比,当物质的量不变时,气体平均摩尔质量也不变,反应达到平衡状态,C选项正确;由反应式的化学计量数知,单位时间内消耗2 mol CO2,必生成1 mol CH3OCH3,即二甲醚的消耗速率等于其生成速率,反应达到平衡状态,D选项正确。(3)CH3OCH3分子中只存在碳氢键、碳氧键,它们都是共价键,A选项正确;二甲醚含碳、氢、氧元素,燃烧时仍然会产生CO、CO2等大气污染物,B选项错误;CH3OCH3与CH3CH2OH分子式相同,结构不同,互为同分异构体,C选项错误;燃烧热强调生成的水为液态,正确的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 455 kJ·mol-1,D选项错误。(4)从电池装置图看,A电极通入二甲醚和水,B电极通入氧气,该燃料电池中,二甲醚是还原剂,发生氧化反应,A极为负极;氧气发生还原反应,B电极为正极。负极反应式为CH3OCH3-12e-+3H2O=2CO2+
12H+。
本题难度:一般
5、选择题 关于如图装置的叙述,不正确的是(?)
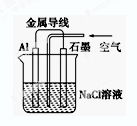
A.铝是负极,铝片上析出无色气体
B.石墨是正极,石墨棒上析出黄绿色气体
C.溶液中两电极间产生白色沉淀
D.溶液中Na+向石墨方向移动
参考答案:AB
本题解析:铝、石墨、氯化钠溶液和导线形成原电池,铝比石墨容易失去电子,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,则铝片上无气体产生,故A错;由于氯化钠溶液显中性,因此铝片发生吸氧腐蚀,则正极反应式为O2+4e—+2H2O=4OH—,没有氯气产生,故B错;负极反应产生的铝离子移向正极,正极反应产生的氢氧根离子移向负极,二者在溶液中相遇时反应生成氢氧化铝沉淀,故C正确;原电池中阳离子移向正极,钠离子是阳离子,石墨是正极,故D正确。
本题难度:一般