1、选择题 在理论上不能用于设计原电池的化学反应是
[? ]
A.HCl(aq)+ NaOH(aq)=== NaCl(aq)+ H2O(l) △H < 0
B.2CH3OH(l)+3O2(g)=== 2CO2(g)+ 4H2O(l) △H < 0
C.Zn(s)+CuSO4(aq)=== ZnSO4(aq)+Cu(s) △H < 0
D.2H2(g)+ O2(g)=== 2H2O(l) △H < 0
参考答案:A
本题解析:
本题难度:简单
2、填空题 请回答下列化学有关问题:
(1)现代工业将煤汽化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1 ,? 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH=?。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=?。(用含ΔH1、ΔH2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验测得相关数据如下图1和图2。
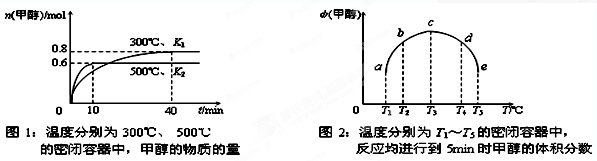
a. 该反应的ΔH3??0(选填“<”、“>”或“=”,下同), K1?K2。?
b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有?。
(2)煤汽化后的煤渣可提炼重金属。右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:
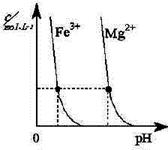
该温度下,溶度积常数的关系为:Ksp[ Fe(OH)3]____Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是?
参考答案:(1)(7分)? ① (ΔH1-ΔH2)/2? ② a.< ?>? b. 降温、增(或加)压
(2)<?由于Ksp[ Fe(OH)3]<Ksp[Mg(OH)2] (1分),浊液中存在溶解平衡:Mg(OH)2 Mg2++2OH-(1分),新加入的Fe3+与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动(1分),最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3(1分)。
Mg2++2OH-(1分),新加入的Fe3+与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动(1分),最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3(1分)。
本题解析:(1)①根据盖斯定律可知,(①-②)÷2即得到C(s)+H2O(g)  CO(g)+H2(g),所以ΔH= (ΔH1-ΔH2)/2。
CO(g)+H2(g),所以ΔH= (ΔH1-ΔH2)/2。
②根据图像可知,温度高,平衡时甲醇的低,说明升高温度,平衡溴逆反应方向移动,因此正反应是放热反应,低温下的平衡常数大,即K1>K2。
③d转化为c,甲醇的物质的量增加,说明平衡向正反应方向移动,因此根据反应式可知,反应是放热的、体积减小的可逆反应,所以改变的条件可以是降温或增(或加)压。
(2)根据图像可知,在金属离子浓度相同的条件下,氢氧化铁形成沉淀需要的pH小,所以氢氧化铁的溶度积常数小于氢氧化镁的。由于Ksp[ Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2 Mg2++2OH-,新加入的Fe3+与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3。
Mg2++2OH-,新加入的Fe3+与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3。
本题难度:一般
3、选择题 镍—镉可充电电池可发生如下反应:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
参考答案:A
本题解析:充电相当于电解池,放电相当于原电池。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。所以根据反应式可知放电时Cd是还原剂,失去电子,作负极,因此答案选A。
本题难度:一般
4、填空题 请仔细观察两种电池的构造示意图,完成下列问题
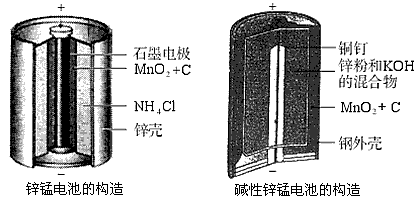
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是
___________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下

已知:生成氢氧化物的pH如下表

①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是_____________________。
③试列举滤液4的应用实例:_____________________________。
参考答案:(1)Zn+2OH--2e-====Zn(OH)2
(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大
(3)①MnOOH、碳粉;②除去Zn(OH)2和Fe(OH)3;③制备皓矾、回收金属锌等
本题解析:
本题难度:一般
5、选择题 如图:一种微型纽扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH溶液。负极的反应式:Zn-2e-+2OH-==ZnO+H2O,该电池总反应式为:Zn+Ag2O==ZnO+2Ag。
根据以上提供的资料,判断下列说法正确的是
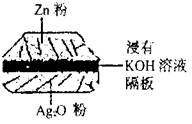
A.正极的反应式: Ag2O +2e-+H2O=2Ag+2OH-
B.放电时负极附近溶液的pH不变
C.放电时每消耗6.5gZn,转移电子0.1mol
D.放电时溶液中阴离子向正极极方向移动,阳离子向负极方向移动
参考答案:A
本题解析:电池总反应式为:Zn+Ag2O==ZnO+2Ag
负极的反应式:Zn-2e-+2OH-==ZnO+H2O
正极的反应式:Ag2O+2e-+H2O ==2Ag+2OH-
B项:由反应式可知,负极反应消耗OH-,故PH减小;
C项:负极式可知,每消耗6.5gZn,转移电子0.2mol
D项:放电时溶液中阴离子向负极方向移动,阳离子向正极方向移动
本题难度:一般