1、填空题 a、b、c、d、e、f、g是原子序数依次增大的前20号元素,其中只有g为金属元素,a是周期表中原子半径最小的元素,b的最外层电子数为电子层数的两倍,b、e ,d、f同主族,且d是地壳中含量最多的元素。试回答下列问题:
(1)a元素中没有中子的同位素的原子组成符号为?,c与a按原子数目比为1∶3构成分子构型为?;a与g的单质可按2∶1化合,试用电子式表示其形成过程?。
(2)a与d形成的化合物中有一种称为“绿色氧化剂”。写出酸性条件下该化合物与FeSO4溶液反应的离子方程式:___________________________________。
(3)bf2的结构式为________________________,它是一种常见的溶剂,通常条件下1克该物质完全燃烧会释放出7.8 kJ的热,试写出该物质燃烧热的热化学方程式:
______________________________________________________________。
(4)标准状况下c的氢化物溶解度为700,用c的氢化物做喷泉实验后所形成的溶液密度为ρ g/cm3,该溶液的物质的量浓度C = ______________(此空用数据列出表达式即可)。?
(5)已知单质A为常见黑色固体粉末,B是元素f的最高价含氧酸,其存在如图所示的转换关系:
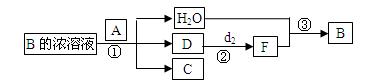
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解,因此反应①的条件 是?;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ? 。
是?;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ? 。
(II) 若A是元素b的单质写出反应①的化学方程式:___________________
参考答案:(1)?11H,?三角锥形,?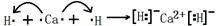 ?(2分)?
?(2分)?
(2)2H++2Fe2++H2O2=2Fe3++2H2O?(2分)
(3)S=C=S?(2分)
CS2(l)+3O2(g) =CO2 (g) + 2SO2 (g);△H =-592 .8 kJ·mol-1(2分)
.8 kJ·mol-1(2分)
(4)1/22.4 mol /L 或0.0446 mol /L?(2分)
(5)(Ⅰ)加热?吸收塔?品红?形成酸雨(各1分共4分)?
(Ⅱ)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O?(2分)
2SO2↑+CO2↑+2H2O?(2分)
本题解析:略
本题难度:一般
2、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如右图所示。下列说法正确的是( )

A.元素X与元素Z的最高正化合价之和的数值等于8
B.元素Y、W的气态氢化物的稳定性,前者比后者差
C.离子Y2-和Z3+的离子半径,后者比前者大
D.元素W的最高价氧化物对应的水化物酸性比Q的强
参考答案:A
本题解析:根据短周期元素X、Y、Z、W、Q在元素周期表中的相对位置可以推出,X是N、Y是O、Z是Al、W是S、Q是Cl,N最高正化合价是+5,Al的最高正化合价是+3,A选项正确,H2O的稳定性强于H2S;B选项不正确;O2-的半径大于Al3+,C选项不正确;H2SO4的酸性弱于HClO4,D选项不正确,。
本题难度:一般
3、填空题 下图为周期表的一小部分,A、B、C、D、E、F的位置关系如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高价氧化物中含氧60%,回答下列问题:
?
| ?
| F
| A
| ?
|
?
| ?
| D
| B
| E
|
?
| ?
| ?
| C
| ?
|
?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
|
(1)A在周期表中的位置为?;E的离子结构示意图为?;化合物DE3的电子式_______。
(2)F元素氢化物的空间构型为_______。
(3)D、B、E元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序?。(用化学式表示)
(4)B、C、E的气态氢化物稳定性由强到弱的顺序是________。(用化学式表示)
(5)B的单质与其最高价氧化物的水化物的浓溶液共热能发生反应,化学方程式为
?。
(6)F2H4和FO2是一种双组分火箭推进剂。两种物质混合发生反应生成F2和H2O(g),已知8g F2H4气体在上述反应中放出142kJ热量,其热化学方程式为?。
(7)请在答题卷相应位置画出金属与非金属元素的分界线。
参考答案:(18分)(1) 第二周期ⅥA组; ?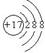 ?;电子式?
?;电子式? ?。
?。
(2)三角锥型 (3)HClO4>H2SO4>H3PO4?(4)HCl>H2S>H2Se ?(5)S+2H2SO4(浓)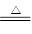 3SO2↑+2H2O
3SO2↑+2H2O
(6)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)?ΔH=-1136 kJ?mol-1
(7)画出金属和非金属的分界线。
?
?
F
A
?
?
?
D
B
E
?
?
?
C
?
?
?
?
?
?
?
?
?
?
?
本题解析:B元素的最高价是负价绝对值的3倍,所以B是第ⅥA族元素,最高价是+6价。它的最高价氧化物中含氧60%,则B的相对原子质量是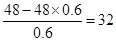 ,所以B是S元素。则A是氧元素,F是氮元素,D是磷元素,E是氯元素,C是Se元素。非金属性越强,最高价氧化物的水化物的酸性越强,则D、B、E元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序是HClO4>H2SO4>H3PO4。非金属性越强,氢化物的稳定性越强,则B、C、E的气态氢化物稳定性由强到弱的顺序是HCl>H2S>H2Se。8g F2H4气体在上述反应中放出142kJ热量,则1molN2H4放出的热量是
,所以B是S元素。则A是氧元素,F是氮元素,D是磷元素,E是氯元素,C是Se元素。非金属性越强,最高价氧化物的水化物的酸性越强,则D、B、E元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序是HClO4>H2SO4>H3PO4。非金属性越强,氢化物的稳定性越强,则B、C、E的气态氢化物稳定性由强到弱的顺序是HCl>H2S>H2Se。8g F2H4气体在上述反应中放出142kJ热量,则1molN2H4放出的热量是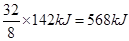 ,所以该反应的热化学方程式是2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)?ΔH=-1136 kJ?mol-1。
,所以该反应的热化学方程式是2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)?ΔH=-1136 kJ?mol-1。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。有利于培养学生的逻辑推理能力和发散思维能力以及规范严谨的答题能力。
本题难度:一般
4、选择题 下列分子中所有原子都满足最外层为8个电子结构的是(?)
A.BF3
B.CCl4
C.H2O
D.PCl5
参考答案:B
本题解析:只要分子中元素化合价的绝对值和该元素原子的最外层电子数之和满足8即能满足最外层为8个电子结构,据此可知选项B正确。答案选B。
本题难度:一般
5、选择题 已知短周期元素R、W、X、Y、Z的原子序数依次增大,其氢化物中上述元素的化合价如下表,下列说法正确的是(? )
?
A.离子还原性:Y2->Z-
B.离子半径W+>Z-
C.气态氢化物稳定性:RH4<XH4
D.酸性:H2YO4<HZO4
参考答案:AD
本题解析: R、W、X、Y、Z是原子序数依次增大的5个短周期元素,从化合价可以判断出它们分别是C、Na、Si、S、Cl。根据元素位置和元素周期律可得离子还原性S2->Cl- ,A正确;离子半径Na +<Cl - ,B错误;C比Si非金属性更强,所以氢化物稳定性CH4>SiH4 ,C错误;Cl比S非金属性更强,所以最高价氧化物对应水化物的酸性H2SO4<HClO4 ,D正确;故选AD。
本题难度:一般