1、填空题 (10分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2) B、F形成的化合物的电子式 ? 。
(3)A、F两种元素最高价氧化物的水化物之间反应的离子方程式 ? 。
参考答案:(10分)(1)Na? Si? P(2)略?(3)Al(OH)3+3H+===Al3++3H2O
本题解析:本题考查的是思维的严密性和连续性,是原子结构、周期表及元素化合物知识的综合应用。A、C、F三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,确定其一必为Al,D原子的最外层电子数比次外层电子数少4个,确定D为Si,E原子的次外层电子数比最外层电子数多3个,确定E为P,又A、B、C、D、E、F六种短周期元素的原子序数依次增大,且A、C、F三原子的最外层共有11个电子,故A为Na,B为Mg,C为Al,F为Cl。
本题难度:一般
2、选择题 下列各组物质中,前者为混合物,后者为单质的是
A.Na2CO3?10H2O、Na2CO3
B.盐酸、液氮
C.石油、冰
D.碘酒、干冰
参考答案:B
本题解析:分析:混合物是含有不同种分子的物质,单质是只有一种元素组成的纯净物.
解答:A、结晶水合物Na2CO3?10H2O属于纯净物,Na2CO3属于化合物,故A错误;
B、盐酸是氯化氢的水溶液,属于混合物,液氮是氮气的液体形式,属于单质,故B正确;
C、石油属于混合物,冰是水的固体形式,属于化合物,故C错误;
D、碘酒是碘的酒精溶液,属于混合物,干冰是二氧化碳的固体形式,属于化合物,故D错误.
故选B.
点评:本题考查学生混合物和单质的概念,可以根据所学知识进行回答,较简单.
本题难度:简单
3、填空题 (10分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
元素
| 25Mn
| 26Fe
|
电离能/kJ·mol-1
| I1
| 717
| 759
|
I2
| 1509
| 1561
|
I3
| 3248
| 2957
|
?回答下列问题:
(1)Mn元素外围电子层的电子排布式为?,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是?。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是?。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 ?晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为?。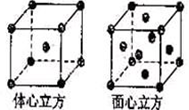
参考答案:(1)3d54s2?;Mn2+ 3d能级电子排布为半满状态,是稳定结构。
(2)有孤电子对 (3)分子 (4)1:2
本题解析:(1)根据构造原理可写出Mn元素外围电子层的电子排布式。锰的原子序数是25,所以外围电子层的电子排布式为3d54s2 。;Mn2+的3d能级电子排布为半满状态,是稳定结构,而亚铁离子的3d能级上有6个电子,不是稳定结构。
(2)要写出配位键,必须有能提供孤电子对的配体。
(3)氯化铁在300℃以上易升华,说明该晶体应该是分子晶体。
(4)在两种堆积方式中含有的铁原子分别为:1+8×1/8=2、6×1/2+8×1/8=4,所以含有的Fe原子个数之比是1︰2。
本题难度:一般
4、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核才有NMR现象。试判断下列哪组原子均可产生NMR现象(?)
A.18O、31P、119Sn
B.27Al、19F、12C
C.7N、15P、33As、51Sb、83Bi
D.只有一个电子层的原子
参考答案:C
本题解析:根据题目提供的信息“只有质子数或中子数为奇数的原子核才有NMR现象”。选项A中,O原子的质子数是8,中子数为18–8=8,都是偶数,不符合要求;选项B中,Al、F中子数分别为27–13=14、19–9=10,C原子质子数和中子数都是6,都为偶数,不符合要求;选项C中,质子数都为奇数,均可产生NMR现象;选项D中包括H和He两种元素,的质子数为2,质量数为4,其质子数和中子数都为2,都为偶数,不符合要求
本题难度:一般
5、选择题 下列有关化学研究的说法正确是
A.根据元素周期表中元素的位置,可以寻找合适的半导体材料
B.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
C.由粗硅制备的反应SiO2 + 2C Si + 2CO↑ 可知非金属性:C > Si
Si + 2CO↑ 可知非金属性:C > Si
D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
参考答案:A
本题解析:在元素周期表中位于金属元素和非金属元素交界处可以寻找半导体材料,A正确;只能改变一个变量来研究反应速率的变化,能更快得出有关规律,B不正确;C中反应是在高温下进行的,不能由此判断元素的非金属性强弱,C不正确;非金属性越强,氢化物的稳定性越强,与氢化物的酸性强弱无关系,D不正确,答案选A。
点评:该题是中等难度的试题,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性,也有助于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般