1、选择题 实验室里需要480 mL 0.1mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是[胆矾(CuSO4·5H2O)]
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
参考答案:D
本题解析:试题分析:由于实验室中没有480mL容量瓶,只能选用500mL容量瓶配制,即需要配制500ml 0.1mol?L-1的硫酸铜溶液,溶液中硫酸铜的物质的量=0.5L×0.1mol?L-1=0.05mol。A、称取硫酸铜的质量=0.05mol×160g/mol=8g,称取7.68g硫酸铜,硫酸铜的质量不足,故A错误;B、胆矾的化学式为CuSO4?5H2O,若称取胆矾,则质量为0.05mol×250g/mol=12.5g,硫酸铜的物质的量不足,故B错误;C、称取8.0 g硫酸铜,加入500 mL水,配制的溶液的体积不是500mL,所以配制的溶液的浓度不是0.1mol/L,故C错误;D、称取12.5 g胆矾,胆矾的物质的量为0.05mol,配成500mL溶液,配制的溶液浓度为0.1mol/L,满足题意,故D正确,答案选D。
考点:考查硫酸铜溶液浓度配制的有关判断和计算
本题难度:困难
2、简答题 选择合适的仪器(或装置)分离或提纯下列各组混和物.(填序号)
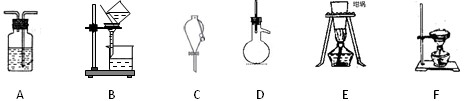
①______分离酒精(沸点为为78.10C)和甲苯(沸点为110.60C)的混合物
②______从硝酸钾和氯化钠混合溶液中提纯氯化钠
③______分离汽油和氯化钠溶液
④______从CO2和HCl混合气体中获得CO2,所需要的试剂是______
A.浓硫酸?B.饱和食盐水?C.氢氧化钠溶液?D.小苏打溶液.
参考答案:①酒精和甲苯互溶,但二者沸点相差较大,可用蒸馏的方法分离,在蒸馏烧瓶中进行操作,故答案为:D;
②硝酸钾和氯化钠都溶于水,但二者在水中的溶解度不同,可用结晶的方法分离,使用仪器为蒸发皿,故答案为:F;
③汽油和氯化钠溶液互不相溶,可用分液漏斗进行分液操作进行分离,故答案为:C;
④CO2和HCl混合气体中获得CO2,可将混合气体通入饱和小苏打溶液,HCl和NaHCO3反应生成CO2,通常在洗气瓶中进行分离,故答案为:A;D.
本题解析:
本题难度:一般
3、实验题 (12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
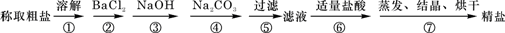
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)步骤2中,判断加入BaCl2已过量的方法是:?
(3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答)? ?。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
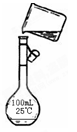
(5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是:?
(6)配制过程中,下列操作情况会使结果偏低的是
A.称量时,托盘天平左盘加砝码,右盘加氯化钠
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容
参考答案:(12分,第一题一空1分,其余每空2分)
(1)玻璃棒漏斗?
(2)在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(其它合理答案也可)? 2分
(3)NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH? 2分
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度? 2分
(5)未用玻璃棒引流;未用200mL容量瓶。2分
(6)AD?各1分,共2分多选、错选不得分。
本题解析:(1)步骤⑤是过滤,需要的玻璃仪器是烧杯、玻璃棒和漏斗。
(2)判断加入BaCl2已过量的方法是继续加入氯化钡溶液,即在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(3)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+和铁离子用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH。
(4)若先用盐酸调pH值再过滤,则在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。
(5)根据示意图可知,存在的错误是未用玻璃棒引流和未用200mL容量瓶。
(6)根据c=n/V可知,称量时,托盘天平左盘加砝码,右盘加氯化钠,则溶质的质量减少,浓度偏小;移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果;定容时,俯视容量瓶刻度线观察液面,则容量瓶中溶液的体积减少,浓度偏高;定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,则容量瓶中溶液的体积增加,浓度偏小,所以答案选AD。
本题难度:一般
4、选择题 利用下列实验装置能完成相应实验的是( )
A.
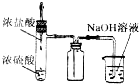
制取并吸收HCl
B.
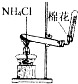
实验室制氨气
C.

除去Cl2中的HCl
D.
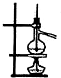
分离液体混合物
参考答案:A.HCl极易溶于水,所以尾气处理时应该防倒吸,故A错误;
B.氯化铵受热分解生成氨气和氯化氢,温度降低时氨气和氯化氢又重新结合生成氯化铵,所以得不到氨气,故B错误;
C.Cl2在饱和食盐水中溶解度很小,而HCl在其中的溶解度很大,所以除去Cl2中的HCl,用饱和食盐水,故C正确;
D.温度计水银球位置不对,水银球应该在蒸馏烧瓶的支管口处,故D错误;
故选C.
本题解析:
本题难度:简单
5、简答题 下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
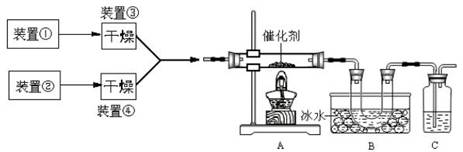
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是?。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因?。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是?(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进?(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。

请回答:装置⑦的作用可能是?;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是?。
参考答案:(1)实验室制取氨气的反应是,2NH4Cl+Ca(OH)2 CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕)
CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕) N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
(2)Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
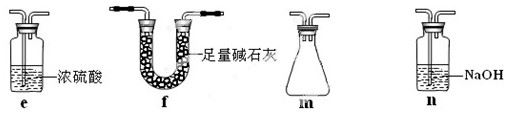
将e、m依次连接在B、C之间或将C装置换成f
(3)吸收未反应的NO? 60%
本题解析:(1))实验室制取氨气的反应是,2NH4Cl+Ca(OH)2 CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕)
CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕) N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
(2)酸性K2Cr2O7溶液氧化未反应的二氧化硫,
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,此装置中存在明显不足是易发生倒吸且空气的水蒸气进入B中,得不到纯净干燥的三氧化硫,需在B、C之间依次加装置e、m,e装置防止空气的水蒸气进入B,m是安全瓶的起防止倒吸,或将C装置换成f装置,既可以吸收二氧化硫,还可防倒吸现象,防止水蒸气进入B中。
(3)装置⑥的作用是吸收未反应的的氨气,则⑦的作用是吸收未反应的NO;根据反应方程式有6NO—5N2,生成标准状况下11.2LN2,消耗NO的物质的量为0.6mol,原有NO的物质的量是22.4L/22.4L/mol=1mol,则NO转化率是60%。
本题难度:一般