1、填空题 (10分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为________;滤渣中含有的物质为____________;
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中与铝的化合物有关的离子方程式_____________________________。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。写出足量CO2通入滤液中所涉及的化学方程式________________。
(5)计算:该样品中铝的质量分数的表达式为___________________________。
参考答案:(10分) 1.(2)Mg2+、Al3+ (2分)? Cu、Si (2分)
(3) Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O
或Al3++4OH-=AlO2-+2H2O?(2分)
(4)NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓?(2分)(5) 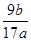 ×100%?(2分)
×100%?(2分)
本题解析:(2)单质铜和硅与盐酸不反应,所以将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为Mg2+、Al3+,滤渣中含有的物质为Cu、Si。
(3)由于氢氧化铝是两性氢氧化物,所以往滤液中加入过量NaOH溶液,生成氢氧化镁白色沉淀,而铝离子先生成氢氧化铝白色沉淀,然后又溶解,反应的离子方程式分别是Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O或Al3++4OH-=AlO2-+2H2O。
(4)偏铝酸钠能和CO2反应生成氢氧化铝白色沉淀,由于CO2过量,所以反应的化学方程式是NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓。
(5)最终生成的是氧化铝,质量是bg,则根据原子守恒可知,该样品中铝的质量分数的表达式为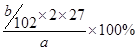 =
=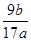 ×100%。
×100%。
点评:该题是中等难度的试题,试题贴近高考,难易适中,注重能力的培养和解题方法的训练,注重解题的灵活性。有利于培养学生的逻辑推理能力和发散思维能力,提高学生分析问题、解决问题的能力。有助于提高学生的应试能力和灵活应变能力。
本题难度:一般
2、选择题 下列各表述与示意图一致的是
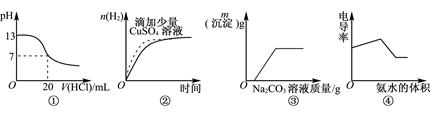
A.图①表示25℃时,0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液
B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.图④表示向盐酸和醋酸混合溶液中滴入氨水
参考答案:C
本题解析:0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;图②中锌与硫酸铜反应置换出铜,从而构成铜锌原电池,加快反应速率,但由于消耗了锌生成的氢气减少,B不正确;向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,碳酸钠首先与盐酸反应,当盐酸被完全消耗后,碳酸钠才能和氯化钙反应生成碳酸钙白色沉淀,C正确;向盐酸和醋酸混合溶液中滴入氨水,生成氯化铵和醋酸铵,溶液的导电性应该是增强的,D不正确,答案选C。
点评:本题结合图象考查了中和滴定、外界条件对反应速率的影响、离子反应以及溶液导电性,属于综合性试题的考查,侧重对学生解题能力的培养,旨在培养学生分析、归纳、总结问题的能力,答题时要做到善于抓规律,有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
3、选择题 某研究性学习小组借助A~D的仪器装置完成有关实验。用装置A收集NO气体,正确的操作是
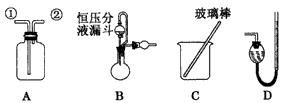
[? ]
A.从①口进气,用排水法集气
B.从①口进气,用排气法集气
C.从②口进气,用排水法集气
D.从②口进气,用排气法集气
参考答案:C
本题解析:
本题难度:一般
4、实验题 (15分)
请设计实验:用MnO2与浓盐酸制备纯净、干燥的Cl2,其他药品与试剂任选。
(1)写出该反应的化学方程式?。
 ?(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必
?(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必 画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如
画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如 下:
下:
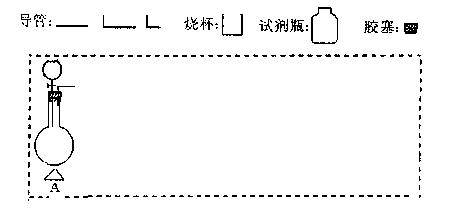
(3)根据方框中的装置图,完成下表(若无需填写,则在表格中写“无”)
仪器符号
| 仪器中所加物质
| 作用
|
A
| MnO2、浓盐酸
| MnO2与浓盐酸生成Cl2
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?(4)KMnO2与浓盐酸在常温下反应也可以得到Cl2,请写出该反应的离子方程式?。
(5)请写出Cl2在工业、农业、医疗、卫生等方面的用途?。(写出两种即可)
(6)将Cl2与SO4分别通人品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法。
参考答案:
(1)MnO2+4HCl(浓)
(2)(3分)

(3)(4分)
仪器符号
仪器中所加物质
作用
B
饱和食盐水
除去Cl2中的HCl
C
浓硫酸
除去Cl2中的H2O
D
无
收集氯气
E
NaOH溶液
尾气处理,防止环境污染
?(4)2MnO4+16H++10Cl-
(5)自来水消毒、制农药、塑料等(2分)
(6)取适量的已褪色的品红溶液于试管中,用酒精灯加热。若品红溶液颜色复原为红色,则为SO2使其褪色;若品红溶液颜色仍为无色,则为C12使其褪色。(2分)
本题解析:略
本题难度:简单
5、选择题 用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是?(?)
A.酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
参考答案:C
本题解析:A中酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定,则盐酸的浓度被稀释,消耗盐酸的体积增加,所以测定结果偏高;B中锥形瓶未用待测液润洗,属于正确的操作要求,不会影响结果;C中读取标准液读数时,滴前仰视,读数偏大。滴定到终点后俯视,读数偏小,所以消耗的盐酸的体积减少,测定结果偏低。D中滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失,说明消耗盐酸的体积增加,所以测定结果偏高,答案选C。
点评:该题是高考中的常见题型和重要考点,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该类试题需要注意的是误差分析的总依据为:由C测==C标V标/V测 由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。
本题难度:简单