1、填空题 下面是实验室可制取氨气的装置和选用的试剂,其中正确的是(?)
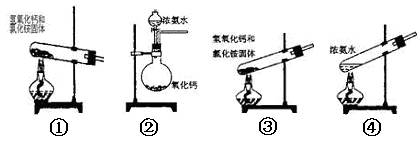
A.①③④
B.只有③
C.①②
D.①②④
参考答案:D
本题解析:①可以制取氨气;②在氨水中存在平衡:NH3+H2O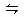 NH3·H2O
NH3·H2O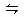 NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O
NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O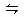 NH3·H2O
NH3·H2O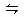 NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
本题难度:简单
2、实验题 (12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
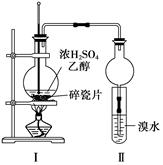

图1?图2
(1)写出该实验中生成乙烯的化学方程式?。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是?。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
?。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是?,B中的试剂为?。
(5)处理上述实验后烧瓶中废液的正确方法是?。
a.冷却后倒入下水道中 ?b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
参考答案:(1)CH3CH2OH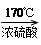 CH2=CH2 ↑+H2O?(2)b、c
CH2=CH2 ↑+H2O?(2)b、c
(3)观察到液体分层,油状液体在下层,证明有溴代烃生成;用pH试纸测定水溶液的pH增大,证明发生加成反应,若发生取代反应则生成HBr,水溶液的pH会明显减小
(4)NaOH溶液(其他合理答案也行)?品红溶液?(5)c
本题解析:(1)乙醇在浓硫酸的作用下加热到170℃发生消去反应生成乙烯,反应的化学方程式为CH3CH2OH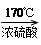 CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(2)乙烯与溴水不易发生取代反应,a不正确;使溴水褪色的反应,未必是加成反应,
B正确;由于浓硫酸具有强氧化性,在反应过程中乙醇被浓硫酸氧化,而浓硫酸的还原产物是二氧化硫,二氧化硫也能使溴水褪色,c正确,乙醇答案选b、c。
(3)如果乙烯与溴水发生加成反应则反应中有卤代烃产生,而卤代烃不溶于水,乙醇如果观察到液体分层,油状液体在下层,证明有溴代烃生成;用pH试纸测定水溶液的pH增大,证明发生加成反应,因为若发生取代反应则生成HBr,水溶液的pH会明显减小。
(4)二氧化硫是酸性氧化物,用NaOH溶液除去即可,为了经验是否除尽,B中应该盛放品红溶液原来检验是否除尽。
(5)实验后烧瓶中废液中含有浓硫酸,浓硫酸密度大于水,溶于水放热,且浓硫酸具有腐蚀性,因此正确的处理方法是冷却后加水稀释,倒入废液缸中,加废碱中和,答案选c。
本题难度:一般
3、选择题 CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:
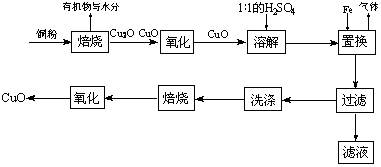
回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+ Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。?
Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。?
?。
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
参考答案:(1)CuO+2H+→Cu2++H2O(2)烧杯、量筒(3)SO2(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有(5)铜粉的质量?最终所得CuO的质量。
本题解析:本题考查工业流程题。(1)氧化铜与硫酸反应的离子方程式;(2)配制硫酸溶液需要的玻璃仪器有烧杯、量筒和玻璃棒;(3)因为是1:1的硫酸,浓度较大,铜没有氧化完全,可能含有部分的Cu2O,与硫酸反应氧化还原反应,生成二氧化硫气体;(4)取少许样品,加入稀H2SO4,若溶液中出现红色沉淀,说明样品中中含有Cu2O,反之则没有;(5)如果铜没有损耗,则根据铜元素的守恒,测得最终所得CuO的质量即可求出样品铜的质量,再测得原铜粉的质量,就可以求出铜粉中Cu的含量。
本题难度:一般
4、实验题 (2014届上海市十三校高三测试化学试卷)
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
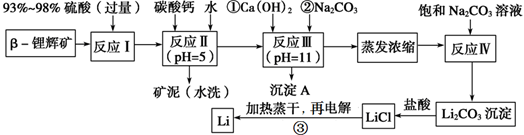
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
| Fe(OH)3
| Al(OH)3
| Mg(OH)2
|
开始沉淀pH
| 2.7
| 3.7
| 9.6
|
完全沉淀pH
| 3.7
| 4.7
| 11
|
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由? ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:
(流程常用的表示方式为: )
)
参考答案:
(1)2FeO+4H2SO4(浓) Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
(2)除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀
(3)不能,镁离子不能完全除去。
(4)晶体膜
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
(6)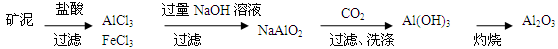
或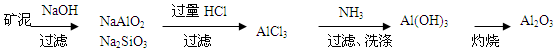
本题解析:
(1)浓硫酸有氧化性,FeO有还原性,二者在加热时会发生氧化还原反应。根据质量守恒定律和电子守恒可得该反应的方程式为:2FeO+4H2SO4(浓)  Fe2(SO4)3+SO2↑+4H2O。
Fe2(SO4)3+SO2↑+4H2O。
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的剩余的H2SO4;调节溶液的pH,同时使Fe3+、Al3+完全转化为沉淀而除去。
(3)在反应Ⅲ中只需加入碳酸钠溶液,因为其碱性是盐水解产生的,碱性不如NaOH强,而且MgCO3的溶解度比Mg(OH)2大,不能很好的把Mg2+沉淀出去。因此不能达成该步骤的目的。
(4)加热蒸发时,只要看到大量固体析出或者仅余少量液体时,停止加热,利用余热把固体蒸干。
(5)步骤③中电解时,阳极产生的氯气中会混有少量氧气,是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应产生了LiOH混在LiCl中。LiOH受热分解生成Li2O,电解时产生了O2。
(6)水洗后的矿泥中含有Fe2O3、Al2O3、SiO2.可以先加盐酸把Fe2O3、Al2O3溶解变为FeCl3、AlCl3,除去难溶的SiO2.然后向溶液中加入过量的NaOH溶液,发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl。AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。把Fe(OH)3沉淀过滤除去,然后向滤液中通入过量的CO2气体,发生反应NaAlO2+ CO2+2H2O= Al(OH)3↓+NaHCO3.把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。另一种方法是把矿泥用NaOH溶液处理,可以得到NaAlO2和Na2SiO3溶液,而Fe2O3不溶,过滤除去。然后向滤液中加入过量的盐酸发生反应NaAlO2+4HCl= AlCl3+NaCl+2H2O。Na2SiO3+2HCl=H2SiO3↓+2NaCl。把硅酸沉淀过滤除去,再向滤液中通入过量的氨气,发生反应AlCl3+3NH3+3H2O= Al(OH)3↓+3NH4Cl。再把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。
本题难度:一般
5、简答题 (15分)用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:
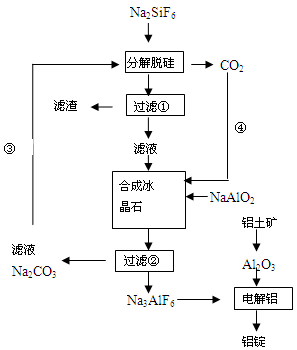
(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________?。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用?。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少??
参考答案:(1)三?Al2O3+2NaOH=2NaAlO2+H2O?
(2)NaF? SiO2
(3)2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF? 6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3?
(4)Na2CO3和CO2循环使用?理论正好,因有损耗均需补充
(5)88.7%
本题解析:(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程,首先加足量的NaOH溶液,使Al转化为AlO2-,再向该溶液中加足量的硝酸或硫酸,这时Al变为Al3+.然后加入足量的氨水得到Al(OH)3沉淀,将其过滤出来,洗涤干净并烘干。最后灼烧Al(OH)3得到纯净的Al2O3。因此需要三个环节。第一步反应的方程式Al2O3+2NaOH=2NaAlO2+H2O。(2)该制备工艺中有两次过滤操作,有流程图可知:在过滤操作①的滤液是NaF;滤渣是SiO2;(3)分解脱硅化学反应方程式是2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF;合成冰晶石化学反应方程式分别为:6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3 ;(4)工艺过程中③和④的目的是Na2CO3和CO2循环使用,提高物质的利用率、节能、环保。由第三步的方程式可知在理论上碳酸钠和二氧化碳恰好完全反应。而在实际应用使由于物质的利用率不可能100%,所以均需补充。(5)一天制Al 1.430 t,n(e-)=1.430×106g÷27g/mol×3=1.6×105mol.电量Q=1.6×105×6.02×1023×1.6×10-19=1.54×1010,消耗的电能n(e-)=2×105×3600×24=1.73×1010,所以电解效率是(1.54×1010÷1.73×1010)×100%=88.7%.
本题难度:一般