1、填空题 下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键?B.极性键
C.非极性键?D.范德华力
E.氢键? F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
参考答案:(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1) 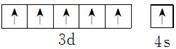 ?F>N>O>C
?F>N>O>C
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
本题解析:根据这几种元素在周期表中的位置推知:A为H(氢),B为Be,C为C(碳),D为N,E为O,F为F(氟),G为Al,H为Cl,I为Cr,J为Fe,(1)Cr元素基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其价层电子排布图为 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
本题难度:困难
2、填空题 (10分)A、B、C三种短周期元素在周期表中相对位置如右图:
?(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是:?>?>?(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g?L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol?L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
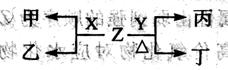 ?
?
①写出X与Z反应的离子方程式:?。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为?,丁的水溶液pH>7的原因是:?(用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式?。
参考答案:(10分)每空2分,共10分
(1)HClO4>H2SO4>H2CO3
(2)①Cl2 + 2OH- = Cl- + ClO- + H2O?②K2S? S2- + H2O HS- + OH-
HS- + OH-
③5SO32- + 2MnO4- + 6H+ = 5SO42- + 2Mn2+ + 3H2O
本题解析:略
本题难度:简单
3、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是(?)
A.一个D2O分子所含有的中子数为8
B.热稳定性:H2S >HF
C.NH3的结构式为:
D.HCl的电子式为: 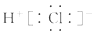
参考答案:C
本题解析:一个D2O分子所含有的中子数为1×2+8=10,A不正确。非金属性是F大于S,所以稳定性是H2S <HF。氨气中含有3个N-H单键,C正确。氯化氢是极性键形成的共价化合物,电子式为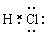 ,D不正确。答案选C。
,D不正确。答案选C。
本题难度:一般
4、选择题 下列物质不属于电解质的是
A.硫酸
B.盐酸
C.氯化钠
D.氢氧化钠
参考答案:B
本题解析:分析:在水溶液里或熔融状态下能导电的化合物是电解质,电解质必须首先是化合物.
解答:A、硫酸在水溶液里能电离出自由移动的离子,硫酸的水溶液能导电,所以硫酸是电解质,故A错误.
B、盐酸是混合物不是化合物,所以盐酸不是电解质也不是非电解质,故B正确.
C、氯化钠在水溶液里能电离出自由移动的离子,氯化钠的水溶液能导电,所以氯化钠是电解质,故C错误.
D、氢氧化钠在水溶液里能电离出自由移动的离子,氢氧化钠的水溶液能导电,所以氢氧化钠是电解质,故D错误.
故选B.
点评:本题考查了电解质的判断,难度不大,易错选项是B,注意:盐酸是混合物不是化合物.
本题难度:简单
5、填空题 A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号?;
(2)C的一价阴离子的结构示意图?;
B的原子的结构示意图?;
(3)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是(?)。
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液?
D.比较这两种元素的气态氢化物的热稳定性
参考答案:(1)Mg? (2)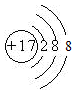 ?
?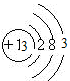 ?(3)BC
?(3)BC
本题解析:A元素有三个电子层,其中最外层电子数占总电子数的1/6,说明A的原子序数是6的倍数,在第三周期元素中,6的倍数的元素有12号元素Mg、18号元素Ar。B元素原子核外电子数比A元素原子核外电子数多1,所以短周期内A只能是Mg,则B是Al;C-离子核外电子层数比A元素的离子核外电子层数多1,则C是第三周期元素Cl;D元素原子最外层电子数是次外层的2倍,说明D是第二周期元素C。
(1)A的元素符号Mg
(2)C的一价阴离子Cl-的结构示意图为 ,B的原子的结构示意图
,B的原子的结构示意图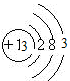
(3)A、镁、铝与冷水不反应,无法判断金属性的强弱,错误;B、与同浓度的盐酸反应,反应剧烈的金属性强,可以判断,正确;C、镁、铝与热水反应,比较反应分快慢及滴入酚酞的颜色变化,可以判断金属性的强弱,正确;D、金属不存在气态氢化物,错误,答案选BC。
本题难度:一般