1、填空题 下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键?B.极性键
C.非极性键?D.范德华力
E.氢键? F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
2、填空题 (10分)A、B、C三种短周期元素在周期表中相对位置如右图:
?(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是:?>?>?(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g?L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol?L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
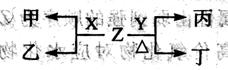 ?
?
①写出X与Z反应的离子方程式:?。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为?,丁的水溶液pH>7的原因是:?(用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式?。
3、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是(?)
A.一个D2O分子所含有的中子数为8
B.热稳定性:H2S >HF
C.NH3的结构式为:
D.HCl的电子式为: 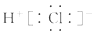
4、选择题 下列物质不属于电解质的是
A.硫酸
B.盐酸
C.氯化钠
D.氢氧化钠
5、填空题 A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号?;
(2)C的一价阴离子的结构示意图?;
B的原子的结构示意图?;
(3)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是(?)。
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液?
D.比较这两种元素的气态氢化物的热稳定性