1、选择题 当光束通过下列分散系时,能产生丁达尔现象的是
A.Fe(OH)3胶体
B.氯化钠溶液
C.盐酸
D.硫酸
参考答案:A
本题解析:能产生丁达尔现象,这是胶体的性质;其余三项都是溶液;
本题难度:简单
2、填空题 有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:?
(1)写出由A、C、D三种元素形成的化合物的电子式?,该化合物的化学键类型为?。
(2)D2E溶液呈?(填“碱性”、“酸性”、“中性”),试用离子方程式解释原因?。
(3)0.5 L 0.1mol·L—1D的最高价氧化物的水化物与0.25L 0.1 mol·L—1E的最高价氧化物的水化物反应放出2865J的热量,该反应的热化学方程式为:?。
(4)由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极电极反应方程式为??。
参考答案:(1) 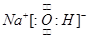 ;离子键、极性共价键
;离子键、极性共价键
(2)碱性? S2-+H2O SH-+OH-
SH-+OH-
(3)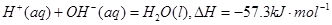
(4)2NH3-6e-+ 6OH- =N2+6H2O
本题解析:由C元素原子最外层电子数是次外层电子数的3倍,可以推断C为O,从而知B为N,E为S,C、E两原子序数之和是A、D两原子序数之和的2倍,可以推断出A为H,D为Na。(2)Na2S溶液呈碱性,多元弱碱阳离子水解逐级水解,S2-+H2O SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57 .3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O
SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57 .3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O
本题难度:一般
3、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.a-3=c+2
B.质子数a>b>c>d
C.离子的还原性Y2-<Z-
D.离子半径X+< W3+< Y2-< Z-
参考答案:A
本题解析:元素的原子失去电子变为阳离子;元素的原子获得电子变为阴离子。A.aW3+和cY2-具有相同的电子层结构,所以a-3=c+2。正确。B.质子数a>b >d>c。错误。C.对于电子层结构相同的离子来说,离子所带的电荷越多,离子的还原性就越强。所以离子的还原性Y2->Z-。错误。D.对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。所以离子半径W3+<X+< Y2-< Z-。错误。
本题难度:一般
4、选择题 下列说法正确的是
A.同一短周期元素的离子半径从左到右依次减小
B.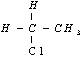 和
和 互为同分异构体
互为同分异构体
C.熔沸点:邻二甲苯 > 间二甲苯 > 对二甲苯
D.第VA族的非金属元素的氢化物中,沸点最高的也最稳定
参考答案:D
本题解析:略
本题难度:一般
5、选择题 16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子
参考答案:D
本题解析:同分异构体是指分子式相同,而结构不同的化合物,A不正确。16O与18O的核外都是8的电子,电子排布方式相同,B不正确。16O与18O的质子数和电子数均相同,二者的转化不属于化学变化。标准状况下,1.12 L 16O2和1.12 L 18O2的物质的量均是0.05mol,且都是双原子分子,D正确。
本题难度:一般