1、计算题 (10分)Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是?
?。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
?。
(3)准确称取上述制备的样品(设Ag2O2仅含Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。
参考答案:(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)0.91
本题解析:(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)。
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)n(O2)=224mL/22.4L·mL-1·1000mL· L-1=1.000×10-2 mol
设样品中Ag2O2的物质的量为x, Ag2O的物质的量量为y,则
248g·mol-1 × x + 232 g·mol-1 ×?y =2.588 g
x+1/2 y =1.000×10-2 mol
因此解得x=9.500×10-3 mol、y=1.000×10-3 mol
所以w(Ag2O2)=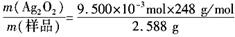 =0.91
=0.91
点评:本题是综合性较强的试题,对学生的要求高。该题难易适中,有利于培养学生规范的实验操作能力,以及规范答题能力。需要学生通过认真的审题、思考,找出问题的关键点,也不难得出正确的结论。
本题难度:一般
2、选择题 已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是
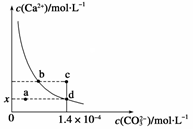
A.x数值为1.4×10-5
B.b点与d点对应的溶度积相等
C.加入蒸馏水可使溶液由d点变到a点
D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等
参考答案:B
本题解析:CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
本题难度:一般
3、选择题 下列说法错误的是?
[? ]
A.等物质的量浓度的醋酸和醋酸钠溶液等体积混合的溶液中一定存在:c( CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
B.常温下将pH=10的氨水稀释10倍,溶液中H+离子的物质的量浓度反而增大
C.在NH4Cl与氨水混合呈碱性的溶液中一定存在:c(NH4+)>c(Cl-)
D.将0. 001 mol/L的AgNO3溶液逐滴滴入含0.001 mol/L的KCl和0.001 mol/L 的K2CrO4混合溶液中,先产生Ag2CrO4沉淀[25℃:Ksp( AgCl)=1.8× 10-10 mol2·L-2; Ksp(Ag2CrO4)=1.9×10-12 mol3· L-3]
参考答案:D
本题解析:
本题难度:一般
4、填空题 将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:(1)取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;
(2)8.0×10-4;
(3)5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;n(MgCl2)= 0.0200mol;n(Cl-)=" n(AgCl)=(4.305g÷143." 5g/mol)×2=0.0600mol;n(KCl)=0.0600mol-2×0.0200mol=0.0200mol;n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.样品中n(KCl)n(MgCl2):n(H2O)=1:1 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
本题解析:将向含光卤石(xKCl·yMgCl2·zH2O)的水溶液中加入过量的NaOH溶液,会发生离子反应:Mg2++2OH-=Mg(OH)2↓,而K+、Na+、Cl-则留在滤液中。在步骤②中若要检验白色固体已洗净,只要证明在滤液中无Cl-即可。方法是取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;(2)在某温度下Mg(OH)2的Ksp = 6.4×10-12,即c(Mg2+)·c2(OH-)≥6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度c2(OH-)≥6.4×10-12÷1.0×10-5 mol·L=6.4×10-7mol/L; c(OH-)≥8×10-4mol/L; (3)在5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;n(MgCl2)= 0.0200mol;n(Cl-)=" (4.305g÷143." 5g/mol)×2=0.0600mol;n(KCl)= n(AgCl)=0.0600mol-2×0.0200mol=0.0200mol;n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.样品中n(KCl)n(MgCl2):n(H2O)=1:1 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
考点:考查沉淀 的洗涤、溶度积常数的应用、守恒法在确定物质化学式的应用的知识。
本题难度:一般
5、填空题 已知100℃时水的离子积Kw是1.0×10-12,回答下列问题:
(1)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(Ksp).如Cu(OH)2?Cu2++2OH-
Ksp=c(Cu2+)?c2(OH-)=2×10-20.溶液里各离子浓度(包括其方次)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解.
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于______.
②要使0.2mol/L?CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+溶液降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液pH为______.
(3)25℃在等体积的①pH=0的H2SO4溶液,②0.05mol?L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是______
(4)在100℃时,向V?mL?pH=a的盐酸中滴加pH=b的NaOH溶液10V?mL,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)的值为______.
参考答案:(1)设氢氧化钠的体积为V1 ,稀硫酸的体积为V2,溶液中10-3V1-10-4V2V1+V2=10-5,V1 :V2=1:9,故答案为:1:9;
(2)①溶液中即C(OH-)=
本题解析:
本题难度:简单