1、填空题 许多在水溶液中的反应,往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度。
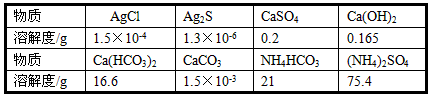
(1)若在有氯化银固体的水中加入硫化钠溶液,可能发生的现象是__________________。
(2)生成硫酸铵化肥的方法之一是:把石膏粉(CaSO4)悬浮于水中,不断通入氨气并通入适量的二氧化碳,充分反应后立即过滤,滤液经蒸发而得到硫酸铵晶体,写出该反应的化学方程式__________________。
参考答案:(1)白色固体消失,同时会生成黑色固体
(2)CaSO4+CO2+H2O+2NH3===CaCO3↓+(NH4)2SO4
本题解析:
本题难度:一般
2、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?)
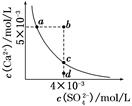
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般
3、选择题 下列叙述正确的是( )
A.25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,向浓度均为0.1?mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1?mol?L-1的Na2CO3溶液,首先生成CaCO3沉淀
B.向硫酸亚铁溶液中加入氯水,再加入KSCN溶液,溶液变为红色,说明硫酸亚铁溶液中存在Fe3+
C.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.除去Cu粉中混有的CuO,可将混合物加入到稀硝酸中,充分反应后过滤、洗涤
参考答案:A.25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,则Ksp(MgCO3)=6.76×10-6>Ksp(CaCO3)=2.8×10-9,所以向浓度均为0.1?mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1?mol?L-1的Na2CO3溶液,首先生成CaCO3沉淀,故A正确;
B.因氯水具有氧化性,将亚铁离子氧化为铁离子,则向硫酸亚铁溶液中先加入KSCN溶液,不变色,再加入氯水溶液变为红色,说明硫酸亚铁溶液中存在Fe2+,故B错误;
C.AgCl也是不溶于水、不溶于酸的白色沉淀,则向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中可能含有Cl-或含有SO42-,但二者不能同时存在,故C错误;
D.因Cu与稀硝酸反应,则除去Cu粉中混有的CuO,可将混合物加入到稀盐酸(或稀硫酸)中,充分反应后过滤、洗涤,故D错误;
故选A.
本题解析:
本题难度:一般
4、实验题 观察下列实验,分析发生反应,得出结论。
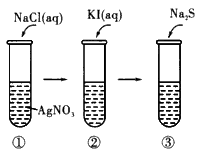
(1)现象____,反应方程式(用离子方程式表示,下同)____。
(2)现象____,反应方程式___。
(3)现象____,反应方程式____。结论___。
参考答案:(1)产生白色沉淀 ;Cl-+Ag+=AgCl↓
(2)产生黄色沉淀 ;AgCl +I -=AgI↓+Cl -
(3)产生黑色沉淀 ;2AgI+S2-=Ag2S↓+2I-? ;沉淀反应向着更难溶物质生成的方向进行
本题解析:
本题难度:一般
5、选择题 向5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(已知?Ksp(AgCl)=1.8×10-10)( )
A.不存在
B.1.8×10-6mol/L
C.1.8×10-7mol/L
D.1.8×10-8mol/L
参考答案:5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液加入后两者浓度分别为
c(Ag+)=0.182=0.09 (mol/L)
c(Cl-)=0.22=0.1 (mol/L)
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.1-0.09=0.01(mol/L)
已知:C(Ag+)×C(Cl-)=1.8×10-10,
则:C(Ag+)=1.8×10-100.01=1.8×10-8(mol/L)
故选D.
本题解析:
本题难度:一般