1、选择题 下列说法正确的是?
A.0.1 mol·L-1的醋酸溶液加水稀释, 减小
减小
B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大
D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2
参考答案:A
本题解析:向水中加入少量固体硫酸氢钠,c(H+)增大,但KW只与温度有关,故KW保持不变,C错;若HA为强酸,则V1=V2,若HA为弱酸,则V1>V2,D错。
本题难度:一般
2、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是(?)
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)
参考答案:BC
本题解析:略
本题难度:一般
3、选择题 (10分)写出下列物质在水中的电离方程式:
NaHSO4 HClO
Al(OH)3 Ca(OH)2
H2CO3
参考答案:NaHSO4=Na++H++SO42-; HClO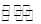 H++ClO-; Al(OH)3
H++ClO-; Al(OH)3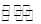 Al3++3OH-; Ca(OH)2=Ca2++2OH-; H2CO3
Al3++3OH-; Ca(OH)2=Ca2++2OH-; H2CO3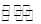 H++HCO3-; HCO3-
H++HCO3-; HCO3-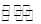 H++CO32-
H++CO32-
本题解析:
试题解析:硫酸氢钠是强电解质,能完全电离出钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4=Na++H++SO42-;HClO是弱电解质,不完全电离,电离方程式为:HClO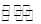 H++ClO-;氢氧化铝是弱碱,不完全电离,电离方程式为:Al(OH)3
H++ClO-;氢氧化铝是弱碱,不完全电离,电离方程式为:Al(OH)3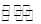 Al3++3OH-;Ca(OH)2是强电解质,能完全电离出钙离子、氢氧根离子,电离方程式为:Ca(OH)2=Ca2++2OH-; 碳酸是弱电解质,分步电离,电离方程式为:H2CO3
Al3++3OH-;Ca(OH)2是强电解质,能完全电离出钙离子、氢氧根离子,电离方程式为:Ca(OH)2=Ca2++2OH-; 碳酸是弱电解质,分步电离,电离方程式为:H2CO3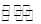 H++HCO3-;HCO3-
H++HCO3-;HCO3-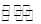 H++CO32-。
H++CO32-。
考点:电离方程式的书写
本题难度:一般
4、选择题 H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
A.增大
B.减小
C.不变
D.可能增大,也可能减小
参考答案:D
本题解析:降温,平衡逆向移动,PH增大,c(S2-)减小,加碱,则pH增大,c(S2-)也增大。选D。
本题难度:一般
5、简答题 常温下有下列四种溶液:
| ① | ② | ③ | ④
溶液
pH=4的NH4Cl
pH=4的盐酸
0.1mol?L-1的醋酸
0.1mol?L-1的NaOH
|
已知该温度下醋酸的电离平稀常数Ka=1.8×10-5.请回答下列问题:
(1)用④的标准液滴定③宜选用______(填“石蕊”、“酚酞”或“四基橙”)作为指示剂.
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是______(用序号表示),用pH试纸测定溶液pH的操作方法是______.
(3)在溶液①中加入少量镁粉,可闻到一股刺激性气味.该反应的离子方程式为______.
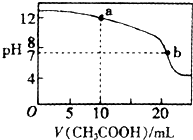
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为______.若b点时消耗③的体积为VmL,则V______(填“>”、“<”或“=”)20.
参考答案:(1)用氢氧化钠溶液滴定醋酸时,醋酸钠是强碱弱酸盐,醋酸根离子水解而使醋酸钠溶液呈碱性,酚酞试液的pH变色范围为:8-10,所以要选取酚酞作指示剂,故答案为:酚酞;
(2)酸或碱稀释时溶液的pH发生变化,强酸或强碱溶液的pH变化大,稀释过程中,促进弱电解质电离,所以弱酸或弱碱溶液的pH变化小,所以pH变化最小的是③,用pH试纸测定溶液pH的操作方法是:用玻璃棒蘸取待测液点在试纸上并跟标准比色卡对比,
故答案为:③;用玻璃棒蘸取待测液点在试纸上并跟标准比色卡对比;
(3)氯化铵是强酸弱碱盐,铵根离子易水解生成一水合氨而使其溶液呈酸性,镁和酸反应放出热量而导致溶液温度升高,从而促进一水合氨分解,所以可闻到一股刺激性气味,Mg+2NH4+=Mg2++2NH3↑+H2↑,
故答案为:Mg+2NH4+=Mg2++2NH3↑+H2↑;
(4)a点为等量的CH3COONa和NaOH,溶液呈碱性,醋酸根离子水解生成氢氧根离子,结合物料守恒知c(Na+)>c(OH-)>c(CH3COO-)>c(H+),b点呈中性,醋酸钠溶液是碱性,要使混合溶液呈中性,则醋酸应该稍微过量,所以V>20mL,
故答案为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+);>.
本题解析:
本题难度:一般