1、填空题 (12分)为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 ?△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
?△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
:
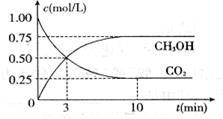
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率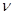 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是??。
 a.容器压强不变? b.混合气体中c(CO2)不变
a.容器压强不变? b.混合气体中c(CO2)不变
c.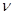 (CH3OH)=
(CH3OH)= 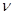 (H2O)? d.c(CH3
(H2O)? d.c(CH3 OH)=c(H2O)
OH)=c(H2O)
 (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
参考答案:(每空2分,共12分)
(1) _____10_? ___min(填“3”或“10”);____0.075_?_ mol/(L·min)。
(2)? a  b?;
b?;
(3)?增大?_(填“增大”或“减小”);
(4)转化率是_____75%______,平衡常数K=_______5.3_______。(计算结果保留一位小数)
本题解析:略
本题难度:一般
2、填空题 (10分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是?。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
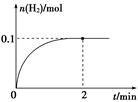
① 0~2 min内的平均反应速率v(HI)=?。
② 该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=?。
2HI(g)的平衡常数K=?。
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。
a.平衡常数? b.HI的平衡浓度
c.达到平衡的时间? d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的?,产生H2的速率将增大。
a.NaNO3?b.CuSO4? c.Na2SO4?d.NaHSO3
参考答案:(1)c ? (2) ①0.1 mol·(L·min)-1 ? ②64 ? ③b? (3) b
本题解析:(1)2SO2+O2+2H2O=2H2SO4是常温下自发进行的,所以2H2SO4===2SO2+O2+2H2O很难在常温下进行,a错误;SO2是还原剂HI是还原产物,所以SO2的还原性强于HI,b错误;三个反应的总反应为2H2O 2H2+O2,所以c正确,d错误。
2H2+O2,所以c正确,d错误。
(2)①v(HI)=
②根据图示可知,平衡时c(H2)=0.1mol/L,则c(I2)=0.1mol/L,c(HI)=0.8mol/L,所以K= 。
。
③若开始加入2molHI,则相当于将原容器增大2倍的压强,平衡不移动,但所有物质的浓度是原来的2倍,所以b正确。
(3)Zn能与CuSO4反应形成Cu—Zn原电池,加快反应速率,所以b正确。
点评:本题综合性强,但是难度不大,根据一般的解题规律很轻松解答。
本题难度:一般
3、选择题 有一可逆反应为A(g)?B(g),下列各项中,能证明已达到平衡的是( )
A.c(A)=c(B)
B.压强不再发生变化
C.A与B的体积分数不再发生变化
D.A的消耗速率等于B的生成速率
参考答案:A、化学平衡状态是正逆反应速率相同,各组分浓度不变,A、B的浓度相同不能证明反应达到平衡,故A错误;
B、反应前后气体体积不变,反应过程中压强不变,压强不再发生变化不能证明反应达到平衡,故B错误;
C、A与B的体积分数不再发生变化是化学平衡的标志,能证明反应达到平衡,故C正确;
D、A的消耗速率等于B的消耗速率才能证明反应达到平衡,故D错误;
故选C.
本题解析:
本题难度:一般
4、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ?;该反应的平衡常数表达式为 ?。
(2)其它条件不变时仅增大压强,则?。
a.K值减小,平衡向逆反应方向移动?
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动?
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 ?。
a.c(N2 ) : c(CO) = 1:3? b.3v(N2 ) = v(CO)
c.固体质量不再改变? d.气体密度不再改变
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。?
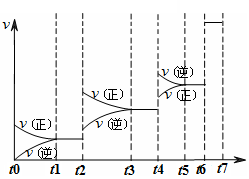
若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ?;图中t6时引起变化的原因可能是?。
由图可知,平衡混合物中CO含量最高的时间段是?。
参考答案:(1)0.25mol/L·min(1分,计算或单位错不给分);?K=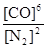 (1分)(2)c?(1分)
(1分)(2)c?(1分)
(3)c、d(1分×2)33、升高温度或缩小体积(增大压强)(1分);加入了催化剂(1分)。
t3~t4(1分)。
本题解析:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数k=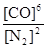 该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
本题难度:困难
5、选择题 纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
A.纳米技术的应用,提高了催化剂的催化性能
B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分离出H2O(g)能加快正反应速率
参考答案:A
本题解析:加压平衡正向移动,但移动的结果不能抵消条件的改变,CO的浓度还是增大的,B项错误;工业生产的温度应考虑催化剂的活性温度,C项错误;从平衡体系中分离出水蒸气,反应速率减慢,D项错误
本题难度:一般