1、选择题 一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
时间(s)
| 0
| 500
| 1000
| 1500
|
t1℃
| 20
| 13.96
| 10.08
| 10.08
|
t2℃
| 20
| a
| b
| c
|
?
下列说法一定正确的是(?)
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08
2、选择题 将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)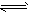 2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
[? ]
A.每生成2mol SO2的同时,消耗2mol SO3
B.混合气体的质量不再变化
C.每生成2mol SO3的同时,消耗2mol SO3
D.每生成2mol SO3的同时,消耗1mol O2
3、填空题 在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
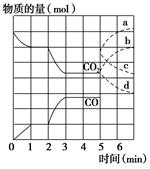
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=________。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH________0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写编号)。
a.v正先增大后减小? b.v正先减小后增大
c.v逆先增大后减小? d.v逆先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:_____________。
4、填空题 N2O5—是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是?。
(2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将? (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s
| 0
| 500
| 1000
|
e(N2O5)/mol·L-1
| 5.00
| 3.52
| 2.48
|
则500 s内N2O5的分解速率为?。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2?T1。
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的?区生成,其电极反应式为?。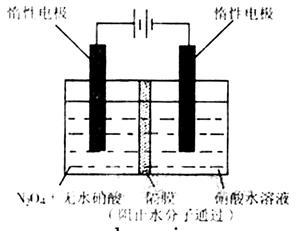
5、选择题 一定条件下可逆反应:2A(g) B(g)+3C(g)在下列四种状态时属于平衡状态的是( )
B(g)+3C(g)在下列四种状态时属于平衡状态的是( )
正反应速率逆反应速率.
A.正反应速率:v(A)=2mol?L-1?s-1
逆反应速率:v(C)=2mol?L-1?s-1
B.正反应速率:v(A)=2mol?L-1?s-1
逆反应速率:v(B)=1.5mol?L-1?s-1
C.正反应速率:v(A)=2mol?L-1?s-1
逆反应速率:v(B)=2mol?L-1?s-1
D.正反应速率:v(A)=1mol?L-1?s-1
逆反应速率:v(C)=1.5mol?L-1?s-1