1、简答题 (1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时值将______(填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
参考答案:(1)①由N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量;l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ,
故答案为:小于;
②A.NH3生成的速率与NH3分解的速率相等,表明正逆反应速率相等,达到了平衡状态,故A正确;
B.混合气体的反应速率23v正(NH3)=v逆(H2),表示的是正逆反应速率,但是不满足化学计量数关系,所以正逆反应速率不相等,没有达到平衡状态,故B错误;
C.容器内的密度不再变化,该反应两边都是气体,气体的质量不变,反应中容器的容积不变,根据ρ=mV可知,密度在反应过程中始终不变,所以密度不能作为判断平衡状态的依据,故C错误;
D.单位时间内消耗a mol N2,同时生成2a mol NH3,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选A;
(2)氨水溶液PH=11,则c(H+)═10-11 mol?L-1,c(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 00
反应(mol?L-1)-)10-3 10-3 10-3
平衡(mol?L-1) 0.1 10-310-3
NH3?H2O的电离平衡常数为:10-3×10-30.1=1.0×10-5;
向此溶液中加入少量的氯化铵固体,溶液中铵离子浓度增大,氨水的电离程度减小,所以氢氧根离子浓度减小,此时c(NH+4)c(OH-)值将增大,
故答案为:10-5;增大;
(3)0.001mol/LAlCl3溶液中铝离子浓度为0.001mol/L,带人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常温下,氢离子浓度为:1.0×10-4mol/L,溶液pH=4,
故答案为:4.
本题解析:
本题难度:一般
2、选择题 可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
A.H2、I2、HI的浓度相等
B.H2、I2、HI的浓度保持不变
C.混合气体的密度保持不变
D.混合气体的质量不再改变
参考答案:A.反应达到平衡时各物质的浓度取决于起始配料比以及转化的程度,平衡时各物质的浓度关系不能用以判断是否达到平衡的依据,故A错误;
B.化学反应达到平衡状态时,各物质的浓度不变,故B正确;
C.由于容器的体积不变,气体的质量不变,则无论是否达到平衡状态,气体的密度都不变,故C错误;
D.化学反应遵循质量守恒定律,无论分那英是否达到平衡状态,气体的质量都不变,不能作为判断达到平衡状态的依据,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 可以证明可逆反应N2+3H2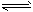 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
[? ]
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体积压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速率v(NH3)=0.4mol/L·min
⑧υ正(N2)=υ逆(NH3)
⑨2υ正(H2)=3υ逆(NH3)
A.全部
B.只有①③④⑤⑨
C.②③④⑤⑦⑨
D.只有①③⑤⑥⑦
参考答案:C
本题解析:
本题难度:一般
4、填空题 (14分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s)?△H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g)?△H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:? 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。
a.体系压强保持不变? b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变? d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=?。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为?(写出一种即可)。
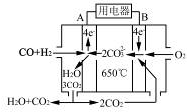
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式?。
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。?
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为?。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是?。
参考答案:(14分)(每空2分)
(1)5CO(g) + I2O5(s)=5CO2(g) + I2(s)?△H=-1377.22kJ·mol-1
(2)b 2.67或8/3
(3)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(4)O2 + 4e-+2CO2 = 2CO32-
(5)①1∶7?
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应
本题解析:能说明反应NO2+SO2 SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
X? X? X
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2?
Y? 0.5y
X+0.5Y=1? /28X+46(X+Y)---44(X+0.5Y)=44?X=1? Y=6
本题难度:一般
5、选择题 下列说法中可以说明2HI(g) H2(g)+I2(g)已达到平衡状态的是(?)
H2(g)+I2(g)已达到平衡状态的是(?)
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
参考答案:(2)(6)(9)
本题解析:判断可逆反应是否已达平衡状态,关键是紧紧围绕这着“等”[υ(正)=υ(逆)]与“定”(条件一定,反应混合物的含量保持不变)这两个因素来判断。而“定”并非是指反应混合物的含量“相等”或者“成比例”。特别反应2HI H2+I2(g)的气体的计量数前后不变。(1)虽然表示的是不同的反应方向,但不能证明υ(正)=υ(逆),故不正确;(2)能表示υ(正)=υ(逆),则此项正确;(3)、(5)是浓度相等或成比例,并不能说明“定”的真正含义,故不正确;(4)速率之比虽然正确,但未指明正逆速率的关系,故不正确;(6)条件一定,某一生成物浓度不再变化,说明了“定”的真正含义,故正确;(7)对于反应2HI(g)
H2+I2(g)的气体的计量数前后不变。(1)虽然表示的是不同的反应方向,但不能证明υ(正)=υ(逆),故不正确;(2)能表示υ(正)=υ(逆),则此项正确;(3)、(5)是浓度相等或成比例,并不能说明“定”的真正含义,故不正确;(4)速率之比虽然正确,但未指明正逆速率的关系,故不正确;(6)条件一定,某一生成物浓度不再变化,说明了“定”的真正含义,故正确;(7)对于反应2HI(g) H2(g)+I2(g),前后气体体积不变,当温度、体积一定时,压强不变不能说明反应已达平衡状态;而对于反应2NO2
H2(g)+I2(g),前后气体体积不变,当温度、体积一定时,压强不变不能说明反应已达平衡状态;而对于反应2NO2 N2O4;前后气体体积不相等,当温度、体积一定时,压强不变能说明任何物质的物质的量不变,为“定”值,故反应已达平衡状态;(8)对于反应2HI(g)
N2O4;前后气体体积不相等,当温度、体积一定时,压强不变能说明任何物质的物质的量不变,为“定”值,故反应已达平衡状态;(8)对于反应2HI(g) H2(g)+I2(g),前后气体物质的量不变,质量不变,混合气体的平均相对分子质量不再变化不能说明反应已达平衡;而对于反应2NO2
H2(g)+I2(g),前后气体物质的量不变,质量不变,混合气体的平均相对分子质量不再变化不能说明反应已达平衡;而对于反应2NO2 N2O4,前后气体物质的量不相等,质量不变,混合气体的平均相对分子质量不再变化能说明任何物质的物质的量不变,为“定”值,故反应已达平衡;(9)混合气体的颜色不再发生变化,说明各物质的浓度不变,证明反应已达平衡状态;(10)对于反应2HI(g)
N2O4,前后气体物质的量不相等,质量不变,混合气体的平均相对分子质量不再变化能说明任何物质的物质的量不变,为“定”值,故反应已达平衡;(9)混合气体的颜色不再发生变化,说明各物质的浓度不变,证明反应已达平衡状态;(10)对于反应2HI(g) H2(g)+I2(g);前后气体物质的量不变,当温度、压强一定时,体积不变,密度不变,不能说明反应已达平衡状态;而对于反应2NO2
H2(g)+I2(g);前后气体物质的量不变,当温度、压强一定时,体积不变,密度不变,不能说明反应已达平衡状态;而对于反应2NO2 N2O4,前后气体物质的量不相等,当温度、压强一定时,体积不变,密度不变,能说明反应已达平衡状态。
N2O4,前后气体物质的量不相等,当温度、压强一定时,体积不变,密度不变,能说明反应已达平衡状态。
本题难度:一般